20. МЕТАЛИ
20. МЕТАЛИ
20.1. Загальна характеристика металів
Класифікація металів.
Існують різноманітні способи класифікації металів. Наведемо загальну класифікацію з урахуванням фізичних властивостей металів.
Усі метали поділяють на дві велику групи: чорні та кольорові.
Чорні метали – темно-сірого кольору, з високою густиною (крім лужноземельних), мають високі температури плавлення та кипіння, високу твердість. Серед них виділяють:
1. метали родини заліза – Fe, Co, Ni, а також Mn. Їх застосовують для одержання сплавів заліза;
2. тугоплавкі метали – температура плавлення яких перевищує температуру плавлення заліза (1536 0С) – Мо, W. Застосовуються як легуючі добавки до сталей;
3. уранові метали – актиноїди – метали ІІІВ підгрупи V періоду;
4. рідкісноземельні метали – лантаноїди – метали ІІІВ підгрупи VII періоду;
5. лужні та лужноземельні метали – елементи ІА та ІІА підгруп.
Кольорові метали – забарвлені (жовті, червоні, білі), м’які, пластичні, мають низькі температури плавлення та кипіння. Їх поділяють на:
1. легкі метали – лужні метали, Be, Mg, Al (густина не більша 5 г/см3);
2. благородні метали – Ag, Au, метали родини платини (VIIIB підгрупа, 5 і 6 період). Усі вони хімічно малоактивні.
3. легкоплавкі метали – температура плавлення яких нижча від температури плавлення заліза.
Фізичні властивості металів.
Основний вплив на фізичні властивості має електронна структура атома і будова кристалічної гратки металу (рис. 20.1.). Найчастіше у металів зустрічаються об’ємно-центровані кубічні (Li, Na, K, Cr, Fe) (рис. 20.1, а), гранецентровні кубічні (Al, Ca, Cu, Ag, Au) (рис. 20.1, б), гексагональні (Be, Mg, Co, Zn) кристалічні гратки (рис. 20.1, в).
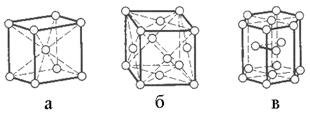
Рис. 20.1. Типи кристалічних ґраток металів (пояснення у тексті).
Кристалічна гратка металів складається із позитивно заряджених катіонів і нейтральних атомів металу, між якими рухаються валентні електрони, які зв’язують усі атоми в кристалі у єдине ціле (“усуспільнені” електрони). Такий тип зв’язку називають металічним.
Температури плавлення і кипіння. За звичайних умов метали – тверді речовини (за винятком Hg). Температури плавлення змінюються у широких межах – від –39 0С у Hg до 3420 0С у W. Температури кипіння металі вдуже високі (у Pt 4350 0С, у Cu 2877 0С). У періодичній системі зі зростанням порядкового номера елемента металу в періоді зростають температури плавлення та кипіння.
Електропровідність металів зумовлена наявністю в кристалічних гратках рухливих електронів, які навіть при невеликій різниці потенціалів рухаються від негативного полюса до позитивного. За звичайних умов найкраще електричний струм проводять срібло і мідь, найгірше – свинець і ртуть.
З підвищенням температури зростає сила коливання атомів у вузлах кристалічних граток, що утруднює рух електронів, тому електропровідність знижується. При зниженні температури, коливання зменшуються і електропровідність зростає.
Теплопровідність визначається тими ж факторами, що й електропровідність. Найкраще тепло проводить срібло, найгірше – бісмут і ртуть.
Металічний блиск характерний для всіх металів. Як правило метали – сірого або білого кольору, однак є і забарвлені метали: мідь – червона, золото – жовте. Часто на повітрі метали вкриваються оксидною плівкою і втрачають блиск.
Густина металів зменшується зі зменшенням атомної маси елемента і збільшенням атомного радіуса. Найлегший метал – літій (густина 0,53 г/см3), найважчий – осмій (густина 22,5 г/см3). Літій, натрій та калій – єдині метали, легші за воду.
За магнітним властивостями виділяють метали:
1. парамагнітні – втягуються в магнітне поле за рахунок неспарених електронів – d-елементи: ванадій, ніобій, тантал;
2. діамагнітні – виштовхуються з магнітного поля – цинк, ртуть, мідь;
3. феромагнітні – зберігають намагнічений стан протягом певного часу – залізо, кобальт, нікель.
Основними механічними властивостями металів є твердість, пластичність, міцність.
Твердість – опір проникненню в метал іншого твердого тіла. Найтвердіші метали – вольфрам, хром (ріжуть скло), найм’якіші – лужні (ріжуться ножем).
Пластичність – здатність змінювати форму без руйнування і зберігати її після припинення дії деформуючої сили. Найпластичніші – золото (з 1 г золота можна витягнути нитку довжиною 2000 м), срібло і мідь.
Міцність – здатність не руйнуватись під дією навантаження.
Загальні хімічні властивості металів.
Характерні хімічні властивості металів обумовлені будовою зовнішнього електронного рівня. Як уже зазначалось (табл. 13.4), у зв’язку з малою кількістю електронів на зовнішньому електронному рівні, атоми металів у хімічних реакціях їх легко віддають, перетворюючись у позитивно заряджені катіони. Проте здатність віддавати електрони у різних металів різна, і чим вона вища, тим активніше метал реагує як відновник.
Зі зростанням кількості електронів на зовнішньому електронному рівні, зростає енергія іонізації і активність металів зменшується. Окрім того, легкість віддачі електронів залежить від того, наскільки далеко вони розташовані від ядра. Зі зменшенням атомного радіуса електрони сильніше притягаються до ядра і тим важче їх відірвати.
Зі сказаного можна зробити висновок: оскільки кількість електронів в атомах в межах періоду зростає зліва направо, а радіус атома зростає в межах групи зверху вниз, то активність металів буде зростати в періоді справа наліво, а у межах групи – зверху вниз. Зі сказаного випливає, що найактивнішими будуть лужні метали, оскільки легше віддати один електрон, ніж прийняти сім, для утворення октету – завершеного стійкого електронного рівня (типу благородного газу), а малоактивними будуть платинові метали, яким до октету не вистачає від 1 до 3 електронів.
Розглянемо реакції металів з типовими окисниками.
І. Дія деяких неметалів на метали (активність неметалів-окисників зменшується зверху вниз).
1. Галогени утворюють галогеніди – солі відповідних безоксигенових кислот:
2Me + xHal = 2MeHalx, 2Fe + 3Cl2 = FeCl3.
2. Оксиген утворює оксиди (з золотом і платиною не реагує), з лужними металами – пероксиди:
4Me + xO2 = 2Me2Ox, 4Al + 3O2 = Al2O3,
2Me + O2 = Me2O2, 2Na + O2 = Na2O2.
3. Сульфур утворює сульфіди – солі сульфідної кислоти (з деякими металами не реагує навіть при нагріванні):
2Me + xS = Me2Sx, Fe + S = FeS.
4. Гідроген з лужними і лужноземельними металами утворює гідриди:
2Me + хН2 = 2MeНx, Са + Н2 = СаН2.
Деякі платинові метали добре поглинають водень (1 об’єм паладію поглинає до 900 об’ємів водню), що зумовлює їх використання як каталізаторів в реакціях гідрування органічних сполук.
5. Нітроген утворює нітриди з лужними і лужноземельними металами:
6Ме + хN2 = 2Me3Nx, 3Mg + N2 = Mg3N2.
Деякі метали (алюміній, берилій, титан) на повітрі вкриваються оксидною плівкою (пасивуються), що запобігає подальшому окисненою металу. Пасивація спостерігається і при дії на метали інших окисників (галогенів, кислот) і супроводжується утворенням захисних плівок відповідного типу (галогенідів, солей).
ІІ. Дія води на метали.
З водою за звичайних умов реагують лише лужні і лужноземельні метали з утворенням відповідних гідроксидів і виділенням водню:
2Ме + 2хН2О = 2Ме(ОН)х + Н2, 2Na + 2Н2О = 2NaОН + Н2.
При високих температурах з водою реагують більшість металів:
2Fe + 6Н2О = 2Fe(ОН)3 + 3Н2.
ІІІ. Дія кислот на метали.
З кислотами-неокисниками (галогеноводні, сульфідна, розбавлена сульфатна) реагують активні метали, розташовані у ряду стандартних електродних потенціалів до водню з утворенням відповідних солей і водню:
Fe + 2НCl = FeCl2 + Н2.
У такі реакції не вступають метали, вкриті захисною плівкою (берилій, алюміній, ніобій, тантал).
Концентровані нітратна і сульфатна кислоти реагують з більшістю металів. Продукти їх взаємодії з металами розглянуті при вивченні хімічних властивостей відповідних кислот.
IV. Дія лугів на метали.
За звичайних умов з лугами реагують лише амфотерні метали – берилій, алюміній, цинк, олово, свинець:
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2.
У результаті таких реакції виділяється водень і утворюються комплексні сполуки.
IV. Дію розчинів солей на метали вперше вивчав М.М. Бекетов (Росія). На основі експериментальних даних він склав витискувальний ряд металів (сучасна назва – ряд стандартних електродних потенціалів) (див. Основи електрохімії).