20. МЕТАЛИ
20. МЕТАЛИ
20.4. Корозія металів і способи її запобігання
Як зазначалось вище, для переважної більшості металів вільний стан нестабільний і з часом вони переходять у стійку окиснену форму. На практиці з цим часто стикаються при експлуатації виробів з металів і сплавів. Під впливом зовнішнього середовища вони поступово руйнуються втрачаючи при цьому початкові фізичні та хімічні властивості.
Руйнування металів і сплавів під дією зовнішнього середовища (води, повітря) називається корозією.
Корозія може охоплювати всю поверхню виробу (тотальна), або лише його окремі ділянки (локальна) корозія.
Залежно від механізму, виділяють хімічну та електрохімічну корозію.
Хімічна корозія відбувається при безпосередньому контакті металу з розчинами неелектролітів, сухими газами тощо. У цьому випадку проходить окиснення металу окисниками – компонентами оточуючого середовища.
Хімічну корозію зумовлюють кисень повітря, пари води, вуглекислий газ CO2, сульфур (IV) оксид SO2, хлор Cl2, гідроген хлорид HCl тощо. Зокрема, корозія заліза в атмосфері кисню (на повітрі) зумовлена проходженням процесу:
4Fe + 3O2 = 2Fe2O3.
Деякі метали (алюміній, цинк, хром нікель) під дією кисню утворюють оксидні плівки які захищають метал від подальшого руйнування:
4Al + 3O2 = 2Al2O3.
При механічному або хімічному руйнуванні плівки корозія проходить далі. У заліза оксидна плівка пориста і тому не захищає метал від подальшої корозії.
Хімічній корозії піддаються деталі двигунів внутрішнього згорання, газових турбін, хімічна апаратура.
Інтенсивність корозії зростає при підвищенні температури, зростання сили окисника і активності металу.
Провідне місце займає електрохімічна корозія – руйнування металів і сплавів при контакті з іншими металами та розчинами електролітів. Електролітами можуть бути пори води в повітрі, ґрунтові води, морська вода тощо. У цьому випадку відбувається перенос електронів, що зумовлює проходження окисно-відновних процесів – виникає гальванічний елемент (рис. 20.1).
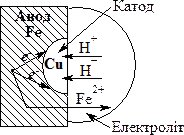
Рис. 20.1. Схема електрохімічної корозії.
Коли активніший метал (наприклад, залізо) забруднений менш активним металом (домішка міді), на його поверхні при стиканні з електролітом відбувається окиснення активного металу (заліза) і його перехід у розчин у формі катіонів:
Fe0 – 2e– = Fe2+
Таким чином, залізо є анодом.
Електрони переміщуються на менш активний метал (мідь), виникає їх надлишок, мідь стає катодом, на якому можливе проходження процесів відновлення. Найчастіше відновлюються іони Н+ (при рН < 7), або молекули О2, розчинені у воді. У першому випадку відбувається процес: 2Н+ + 2е– = Н2 (воднева деполяризація); у другому: О2 + 2Н2О + 4е– = 4ОН– (киснева деполяризація).
Виникають гальванічні елементи, схеми яких відповідно записують:
(–) Fe ½ Fe2+ (H2O) H+ ½ H2 (Cu) (+),
(–) Fe ½ Fe2+ (H2O) OH– ½ O2 (Cu) (+).
Електрохімічна корозія інтенсифікується при зростанні різниці стандартних електродний потенціалів металів, що утворюють гальванічний елемент, агресивності середовища, концентрації окисника, підвищенні температури.
Корозія металів і сплавів відбувається безперервно і завдає значної економічної шкоди. У результаті корозійних процесів виходить з ладу обладнання, машини, механізми, руйнуються металеві конструкції. Особливо інтенсивно кородує апаратура хімічних і металургійних виробництв. Тому розробка ефективних способів захисту від корозії – важливе завдання сучасної хімічної науки.
Знаючи фактори, що спричиняють корозію, розробляються спеціальні наукові підходи до питання захисту металів від окиснення і руйнування. Розглянемо деякі з них.
Нанесення захисних покриттів (металічних, неметалічних, полімерних, лакофарбових) – пасивує метал шляхом утворення оксидів, карбідів, нітридів тощо або перешкоджає фізичному доступу агресивних реагентів.
Для захисту виробів із заліза і сплавів на його основі, їх покривають цинком, який є активнішим, ніж залізо, але за рахунок наявності оксидної плівки ZnO захищає залізо від руйнування. При механічному пошкодженні захисного шару за наявності води виникає гальванічний елемент:
Zn ½ O2, H2O ½ Fe.
Цинк, як активніший метал є анодом і розчиняється згідно схеми:
2Zn0 + 4OH– = 2Zn(OH)2.
Коли розчиниться весь цинк, починає руйнуватись залізо (рис. 20.2).
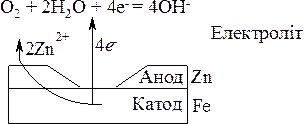
Рис. 20.2. Схема корозії залізного виробу, покритого шаром цинку.
Крім цинкових, застосовують й інші покриття залізних виробів (хромування, нікелювання), які окрім того, надають привабливого вигляду.
Для підвищення корозійної стійкості метали легують – вводять невеликі кількості легуючих добавок (найчастіше хром, нікель, марганець, берилій).
Лакофарбові покриття відзначаються вологостійкістю і забезпечують механічний захист від корозії.
Для захисту металевих конструкцій від морської води і ґрунтової корозії використовують електрохімічні методи (протекторний та електрохімічний захист).
При приєднанні до деталі протектора (лат. protector – захисник), виготовленого з активного металу виникає гальванічний елемент – метал основної конструкції захищений за рахунок корозії протектора (протекторний захист). Вироби із заліза і його сплавів захищають протекторами з цинку або магнію В міру руйнування протекторів, їх заміняють новими.
За схожим принципом діє електрохімічний захист. Металеву конструкцію приєднують до негативного полюса джерела струму за рахунок чого вона стає катодом. Позитивний полюс приєднують до допоміжного металу – аноду, який поміщають у ті ж умови, що й основний метал (грунт, воду). На поверхні основного металу відновлюються окисники зовнішнього середовища, а допоміжний метал розчиняється. Такий метод використовують для захисту трубопроводів, корпусів суден.
Радіус дії електрохімічного захисту становить до 2 км, протекторного – 50 м, тому зараз в основному використовують електрохімічний захист.
Ефективні методи хімічного захисту від корозії шляхом застосування інгібіторів корозії. Речовини, що сповільнюють корозію (інгібітори), вводять в середовище експлуатації виробу або наносять на його поверхню. Як інгібітори використовують різноманітні неорганічні (нітрити, хромати, силікати, фосфати) та органічні (уротропін) речовини.