24. ФЕРУМ. ЗАЛІЗО
24. ФЕРУМ. ЗАЛІЗО
24.1. ФЕРУМ. ЗАЛІЗО. ВЛАСТИВОСТІ
Ферум – представник перехідних елементів, знаходиться у VIIIB підгрупі Періодичної системи хімічних елементів.
Електронна будова атома Феруму 1s22s22р63s23р63d64s2:
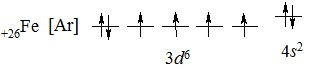
На зовнішньому електронному рівні атом Феруму містить два s-електрони, заповнюється 3d-підрівень, тому Ферум – d-елемент. У хімічних реакціях він віддає 2 електрони з 4s-підрівня з утворенням іона Fe2+, який при відщепленні одного електрона з 3d-підрівня утворює іон Fe3+. Менш характерним є ступінь окиснення +6. За рахунок вільних d-орбіталей Ферум утворює комплексні сполуки з координаційними числами 4, 6 і 8.
Назва “Ферум” походить від лат. “firmus” – міцний. Залізо – один з металів, відомий людству ще з ІХ – VII ст. Першим джерелом заліза були метеорити, згодом люди навчились виплавляти його з руд. У ті часи вартість міді, срібла, золота і заліза відносились як 1:160:1280:6400. Це було зумовлено, з одного боку, рідкістю метеоритного заліза і поширеністю самородних міді, срібла і золота, а з іншого – практичним застосуванням заліза для виготовлення зброї, сільськогосподарських інструментів тощо. В “Одисеї” Гомер згадує, як переможця спортивних ігор Ахіллеса нагородили шматком заліза і шматком золота.
Поширення в природі. Ферум – другий (після Алюмінію) за поширенням метал та четвертий (після Оксигену, Силіцію та Алюмінію) у земній корі (5,2%) елемент. Зустрічається у вільному стані (метеоритне залізо) та у вигляді сполук (табл. 24.1), які використовують для промислового одержання заліза.
Велика кількість самородного заліза (30%) метеоритного походження знаходиться на поверхні Місяця. Через відсутність там атмосфери з окисниками (кисень, вода) усі елементи перебувають у нижчих ступенях окиснення. При виверженні вулканів на Місяці утворюється самородне залізо шляхом відновлення мінералів за високої температури та глибокого вакууму.
Таблиця 24.1
Деякі природні сполуки Феруму
|
Назва мінералу |
Формула |
|
Бурий залізняк (лимоніт) |
2Fe2O3∙3H2O |
|
Залізний колчедан (пірит) |
FeS2 |
|
Магнітний залізняк (магнетит) |
Fe3O4 (або FeO∙Fe2O3; Fe(FeO2)2) |
|
Червоний залізняк (гематит) |
Fe2O3 |
|
Залізний шпат (сидерит) |
FeСO3 |
Пірит рідко використовують для добування заліза, він є основною сировиною для одержання сульфатної кислоти.
Одержання. Сучасні промислові способи переробки залізних руд описані в п. Чавун і сталь.
Залізо високої чистоти одержують прямим відновленням Fe2O3:
Fe2O3 + 3H2 = Fe + 3H2O,
або термічним розкладом (150 – 200 0С, 10МПа) ферум пентакарбонілу:
[Fe(CO)5] = Fe + 5CO.
Фізичні властивості. Чисте залізо – сріблясто-білий метал, з хорошою тепло- та електропровідністю, пластичний, ковкий (табл. 24.2).
Таблиця 24.2
Деякі властивості Феруму і заліза
|
Характеристика |
Ферум і залізо |
|
Порядковий номер |
26 |
|
Атомна маса |
56 |
|
Конфігурація зовнішнього електронного рівня |
3d64s2 |
|
Атомний радіус, пм |
126 |
|
Густина, г/см3 |
7,87 |
|
Температура плавлення, 0С |
1539 |
|
Температура кипіння, 0С |
2870 |
На вологому повітрі залізо тьмяніє, утворюючи пухку плівку гідроксиду, яка не перешкоджає подальшому окисненню металу. Залізо виявляє феромагнітні властивості (речовини, що притягуються магнітом – феромагнетики). Механічні властивості заліза визначаються наявністю домішок, зі зростанням їх кількості якість металу погіршується.
Залізо утворює кілька кристалічних модифікацій, стійких за певної температури (після 768 0С залізо втрачає феромагнітні властивості):
![]()
При зниженні температури відбувається зворотній процес.
Хімічні властивості визначаються наявністю домішок. Чисте залізо – метал середньої активності. Біля м. Делі (Індія) стоїть залізна колона висотою 7 м і масою 6,5 т без жодних слідів корозії, хоча її вік – понад 2800 р. Колона виготовлена із заліза чистотою 99,72%, стійкого до корозії.
Для Феруму характерне утворення сполук Fe+2 i Fe+3, що відповідають оксидам FeO і Fe2O3. Відомі солі фератної кислоти H2FeO4, у яких ступінь окиснення Феруму +6.
І. Взаємодія з простими речовинами.
Залізо при нагріванні реагує з киснем, сіркою, галогенами, вуглецем та азотом з утворенням відповідних бінарних сполук:
3Fe + 2O2 = Fe3O4 (або FeO + Fe2O3); 2Fe + 3Cl2 = 2FeCl3;
Fe + S = FeS; 3Fe + C = Fe3C; 2Fe + N2 = 2FeN
З воднем залізо безпосередньо не реагує.
ІІ. Взаємодія зі складними речовинами.
1. Залізо за нормальних умов реагує з водою і киснем:
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Цей процес – корозія заліза детально розглянуто у п. Корозія металів.
2. Взаємодія з кислотами-неокисниками (HСl або розведена сульфатна) відбувається за нормальних умов і веде до утворення відповідних солей та виділення водню:
Fe + 2НСl = FeCl2 + Н2; Fe + Н2SO4 = FeSO4 + Н2.
3. Взаємодія з кислотами-окисниками (концентрована сульфатна, розбавлена та концентрована нітратна кислоти) веде до утворення солей Fe3+:
Fe + 4HNO3р. = Fe(NO3)3 + NO + H2O;
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Кислоти високих концентрацій пасивують метал, взаємодія не відбувається і тому концентровані HNO3 і H2SO4 перевозять у залізних цистернах.
4. Розпечене до червона залізо реагує з водяною парою:
3Fe + 4H2O = Fe3O4 + 4H2.
5. Залізо витісняє метали, які розташовані після нього у ряду стандартних електродних потенціалів з водних розчинів їх солей:
Fe + CuSO4 = FeSO4 + Cu.