28. Насичені вуглеводні
Насичені ациклічні вуглеводні
Визначення. Алкани – це насичені вуглеводні з відкритим ланцюгом. Вони утворюють гомологічний ряд із загальною формулою СnН2n+2.
Гомологічним рядом називається послідовність подібних за своєю будовою та хімічними властивостями речовин, що відрізняються одна від одної за складом молекул на одну або кілька гомологічних різниць. Гомологічна різниця СН2 відповідає одному атому вуглецю та двом атомам водню, які не завжди входять до складу однієї СН2-групи. Приклад гомологічного ряду: СН4, С2Н6, С3Н8, С4Н10.
Номенклатура. Вживають такі загальні назви насичених ациклічних вуглеводнів: алкани, парафіни, насичені аліфатичні вуглеводні. Наведемо назви окремих сполук:

Ізомерія. В гомологічному ряду алканів спостерігається структурна ізомерія – ізомерія вуглецевого ланцюга, зумовлена різним порядком сполучення атомів вуглецю. Метан, етан і пропан ізомерів не мають. Бутан існує у вигляді двох ізомерів, пентан – трьох (табл. 52). Зі збільшенням числа атомів вуглецю в молекулі число можливих ізомерів зростає. Гексан існує у вигляді п’яти ізомерів, декан – сімдесяти п’яти.
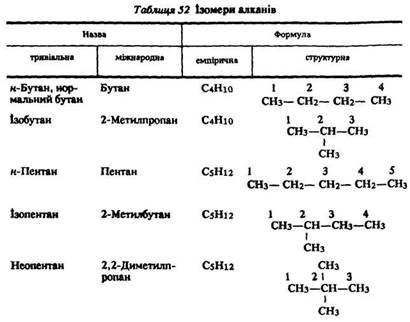
Електронна будова. В молекулах алканів усі атоми зв’язані сигма-зв’язками, в утворенні яких беруть участь гібридні sp3-орбіталі (рис. 19).
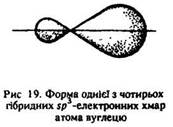
Витягнута грушоподібна форма цих орбіталей забезпечує більше перекривання їх з орбіталями атомів, що приєднуються до вуглецю і цим стабілізують молекулу. Гібридні sp3-орбіталі, перекриваючись з s-орбіталями атомів водню або sp3-орбіталями сусідніх атомів вуглецю, утворюють міцну тетраедричну структуру з чотирма сигма-зв’язками, напрямленими під кутом 109°28’ один до одного (рис. 20).
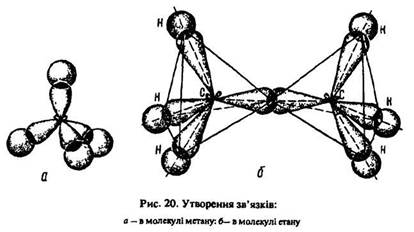
Молекула метану має форму тетраедра (рис. 21, а). Молекула етану С2Н6 містить сім сигма-зв’язків: один зв’язок sp3–sp3 (С–С) і шість sp3–s (С–Н). Вона утворена двома вуглецевими тетраедрами (рис. 21, б).
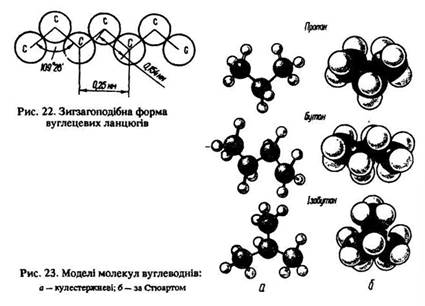
В інших алканів вуглецевий ланцюг має зигзагоподібну просторову конфігурацію (рис. 22, 23). Молекули алканів неполярні.
Поширення в природі. Алкани є досить поширеними природними сполуками. Вони містяться в нафті, природних і супутних газах.
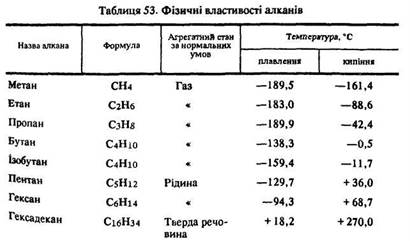
Фізичні властивості. Температури плавлення та кипіння вуглеводнів підвищуються зі збільшенням числа атомів вуглецю в молекулі (табл. 53). Це явище можна пояснити так. Сили міжмолекулярного притягання неполярних молекул вуглеводнів слабкі. З подовженням вуглецевого ланцюга вони збільшуються. Поряд з цим, ізомери з більш розгалуженим ланцюгом мають менші температури плавлення та кипіння.
Усі алкани легші за воду і як неполярні сполуки не розчиняються в ній.
Хімічні властивості. Алкани хімічно інертні, оскільки всі валентності в їх молекулах насичені. Докладно їх хімічні властивості буде розглянуто на прикладі метану СН4.