28. Насичені вуглеводні
Метан
Молекулярна формула метану СH4, структурна:
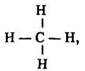
електронна:
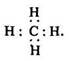
Класифікація. Метан – найпростіший представник алканів. Він не має ізомерів. Будова його молекули наведена раніше (п. 22.2).
Поширення в природі. Метан є головною складовою частиною природного газу (90–98 %). Багато його міститься в газах, які виділяються під час добування та переробки нафти, сухої перегонки деревини, торфу та кам’яного вугілля.
Метан часто називають болотним, або рудниковим газом, оскільки він утворюється в болотах під час гниття рослинних решток без доступу повітря, а також у процесі повільного розкладу кам’яного вугілля під землею.
Фізичні властивості. Метан – це газ без запаху та кольору, легший за повітря, малорозчинний у воді.
Хімічні властивості. Метан, як і всі алкани, хімічно малоактивний – він не вступає в реакції приєднання, не взаємодіє з розчинами перманганату калію та лугів, бромною водою та холодною концентрованою сірчаною кислотою. Реакції окислення метану відбуваються лише за високої температури.
Горіння. Метан горить блідим синюватим полум’ям:
СН4г + 2O2г = СO2г + 2Н2Ог + 880 кДж.
У результаті реакції виділяється велика кількість тепла, тому метан застосовують як горючий газ. Суміші метану з киснем у об’ємному співвідношенні 1: 2 або з повітрям у об’ємному співвідношенні 1: 10 є вибухонебезпечними.
Розклад. Під час сильного нагрівання (1000 °С) метан розкладається на вуглець і водень:
СН4 = С + 2Н2.
Реакції заміщення. Метан вступає в реакції заміщення з галогенами, розведеною азотною та концентрованою сірчаною кислотами під час нагрівання. Галогенування відбувається поступово на світлі. Під дією кванта світла у молекулі галогену, наприклад хлору, розривається ковалентний зв’язок. Внаслідок цього утворюються вільні радикали хлору Сl•, які мають непарний електрон і підвищену кінетичну енергію: Сl2 -> 2С1•. У результаті їх взаємодії з вуглеводнем виникають вільні вуглеводневі радикали:
СН4 + Сl• -> СН3• +НСl.
Ці радикали, в свою чергу, вступають у реакцію з молекулами хлору» утворюючи вільні радикали хлору СН3• + Сl2 -> СН3Сl + +Сl• і т.д. Хімічні реакції, в яких активна частка (вільний радикал, атом або збуджена молекула) спричинює велику кількість (ланцюг) перетворень вихідних молекул внаслідок виникнення активної частки в кожному елементарному акті реакції, називають ланцюговими. За відкриття механізму ланцюгових реакцій російський вчений М. Семенов (1901–1969) був удостоєний у 1958 р. Нобелівської премії. Ці реакції закінчуються утворенням суміші галогенопохідних:
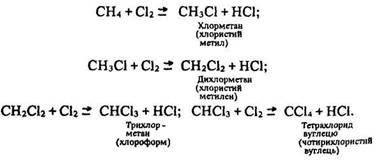
Під дією ультрафіолетового опромінення суміші метану з хлором відбувається вибух за схемою:
СН4 + 2Сl2 -> С + 4НСl.
Способи розриву хімічних зв’язків. Розрізняють два способи розриву хімічних зв’язків: гoмолітичний та гетеролітичний. Гoмолітичний супроводжується розривом спільної електронної пари та виникненням радикалів – атомів чи груп атомів з неспареним електроном:
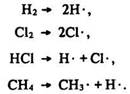
Під час гетеролітичного розриву зв’язку електронна пара переходить до будь-якого атома і утворюються іони протилежного знаку:
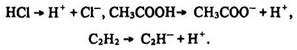
Індукційний ефект. Електронна будова галогенопохідних ряду метану характеризується певними особливостями. Молекули СН3Сl, СН2Сl2, СНСl3 (на відміну від СН4) полярні внаслідок зміщення електронної густини в бік більш електронегативних атомів хлору:
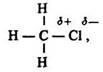
де дельта плюс, і дельта мінус – часткові заряди атомів.
Зміщення електронної пари впливає не лише на атоми, які вона з’єднує (С і Сl), але й на ті, які знаходяться далі в ланцюзі (Н):
Н –> СН2 –> Сl.
Тому в СН3Сl атоми водню заміщуються на атоми хлору легше, ніж у СН4. Здатність атома або групи атомів спричинювати в ланцюзі зміщення електронної густини сигма-зв’язку називають індукційним ефектом.
Індукційний ефект вважається негативним, якщо атом або радикал притягує електрони сусіднього атома, позитивним – якщо відштовхує їх від себе.
Негативний індукційний ефект виявляють групи
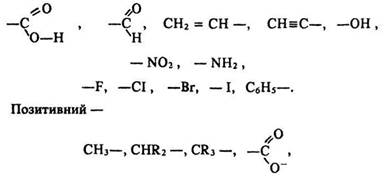
а також атоми металів.
Одержання. Метан у промисловості добувають такими способами:
в результаті реакції водню та графіту за температури 500 °С та наявності каталізатора (нікелю):
С + 2Н2 –> СН4;
внаслідок взаємодії водню та оксиду вуглецю (II), які входять до складу водяного газу:
![]()
Останнім способом можна добути також інші алкани.
У лабораторних умовах метан добувають таким чином: взаємодією карбіду алюмінію з водою:
Аl4С3 + 12Н2O = 4А1(ОН)3 + 3СН4;
нагріванням суміші ацетату натрію з гідроксидом натрію:
СН3СООNa + NаОН = Nа2СО3 + CН4.
Інші алкани можна одержати в результаті взаємодії металічного натрію та галогенопохідних вуглеводнів (реакція Вюрца):
![]()
Використання метану та інших алканів. Метан є сировиною для виробництва хімічних продуктів. Так, неповним окисленням метану при 500 °С добувають ацетилен:
4СН4 + 2O2 = С2Н2 + Н2O + СO2 + СО +6Н2.
З метану одержують також метиловий спирт і формальдегід:
![]()
Метан, ацетилен, формальдегід, метиловий спирт є сировиною для багатьох хімічних виробництв. Окисленням вищих алканів, які містять 20–25 атомів вуглецю, одержують синтетичні жирні кислоти з різною довжиною ланцюга вуглецевих атомів. Ці кислоти використовують для виробництва мила, різких миючих засобів, лаків, емалей, мастила. Алкани застосовують як паливо.