33. Арени
Арени
Визначення. Ароматичні вуглеводні – це карбоциклічні вуглеводні, в молекулах яких містяться ядра бензолу С6H6:
Класифікація. Ароматичні вуглеводні бувають моноциклічними (містять одне бензольне ядро) і поліциклічними (мають кілька ядер бензолу).
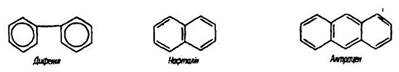
У поліциклічних ароматичних вуглеводнях ядра бензолу сполучаються простим зв’язком (дифеніл і його похідні) або мають кілька спільних атомів вуглецю (нафталін, антрацен):
Моноциклічні ароматичні вуглеводні – це гомологи бензолу, У якого один або кілька атомів водню заміщені вуглеводневими радикалами R.
Номенклатура. Вживається ще така загальна назва ароматичних вуглеводнів – арени. Назву ароматичні вони одержали тому, що перші відомі їх представники мали приємний запах. Однак існує багато ароматичних вуглеводнів без запаху. Назви окремих аренів утворюються з назви першого представника їх гомологічного ряду – бензолу.
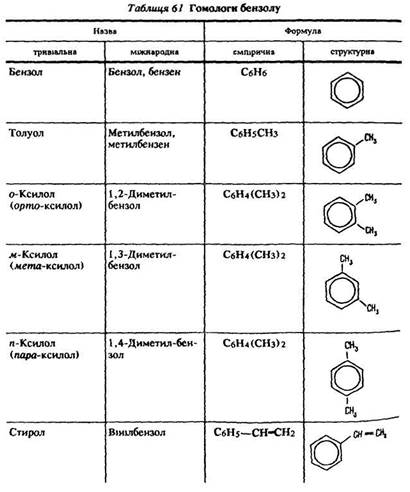
Ізомерія. У ароматичних вуглеводнів, що містять два або більше замісників у ядрі, можлива ізомерія взаємного положення. У таблиці 61 наведені формули трьох ізомерів ксилолу: о-ксилолу – замісники знаходяться в положенні 1, 2; м-ксилолу – в положенні – 1,3; п-ксилолу – в положенні – 1,4.
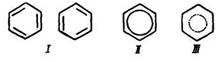
Будова молекули. Найпростішим представником аренів є бензол С6Н6. Його емпірична формула свідчить, що бензол – дуже ненасичена сполука. У 1865 р. німецький хімік А. Кекуле запропонував структурну формулу цього вуглеводню – шестичленне кільце, в якому чергуються прості та подвійні зв’язки (І).
Проте така формула не пояснює його властивостей. Бензол не виявляє властивостей ненасичених сполук: не знебарвлює бромну воду та розчин перманганату калію; для нього більш характерні реакції заміщення, ніж приєднання. Крім того, всі зв’язки між атомами вуглецю в кільці рівноцінні – їх довжина однакова й дорівнює 0,140 нм (як відомо, довжина простого зв’язку становить 0,154 нм, подвійного – 0,133 нм).
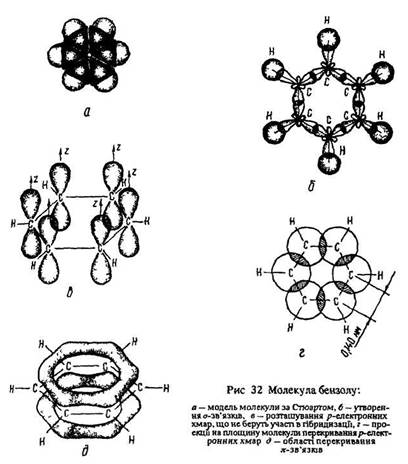
Пояснити такі факти можна за допомогою сучасної теорії будови речовини. Згідно з цією теорією молекула бензолу мас форму площинного шестикутника (рис. 32, а). Кожний атом вуглецю в молекулі бензолу перебуває у стані sр2-гібридизації. Він зв’язаний з двома сусідніми атомами вуглецю й атомом водню трьома сигма-зв’язками. Усі шість атомів вуглецю та пі-зв’язки С–С і С–Н лежать в одній площині (рис. 32, б). р-Орбіталь електрона, що не бере участі в гібридизації, має форму гантелі і розташована перпендикулярно до площини бензольного кільця (рис. 32, в). Такі р-орбіталі сусідніх атомів вуглецю перекриваються над і під площиною кільця (рис. 32, г). У результаті виникає шести електронний пі-зв’язок, спільний для всіх атомів вуглецю. Дві області великої електронної густини розміщені по обидва боки сигма-зв’язків (рис. 32, д). пі-Зв’язок обумовлює скорочення відстані між атомами вуглецю.
Сучасна структурна формула бензолу – правильний шестикутник з колом у середині – суцільним (II) або пунктирним (III). Проте часто користуються також формулою Кекуле (І).
Поширення в природі. Бензол входить до складу нафти.
Фізичні властивості бензолу. Бензол – безбарвна, летка, вогненебезпечна рідина з характерним запахом, яка практично не розчиняється у воді. Пара бензолу з повітрям утворює вибухову суміш. Рідкий бензол і його пара отруйні. За звичайних умов більшість ароматичних вуглеводнів – безбарвні рідини, нерозчинні у воді.
Хімічні властивості бензолу. За хімічними властивостями бензол та інші арени відрізняються від алканів і алкенів. Найхарактернішими для них є реакції заміщення, які відбуваються легше, ніж у алканів.
Реакції заміщення. Галогенування. Це заміщення атомів водню в бензольному кільці галогенами за участю каталізаторів (Fе, FеСl3, АlСl3):
![]()
Бромбензол – безбарвна рідина з температурою кипіння 156 °С, нерозчинна у воді, важча за воду.
Нітрування. Це заміщення атомів водню в бензольному кільці нітрогрупою –NO2 під дією азотної кислоти (за наявності концентрованої сірчаної кислоти):
![]()
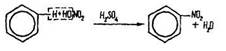
Нітробензол – рідина світло-жовтого кольору з температурою кипіння 210 °С, нерозчинна у воді, важча за воду. Має запах гіркого мигдалю, отруйна.
Сульфування. Це заміщення атомів водню в бензольному ядрі залишком сірчаної кислоти – сульфогрупою –SO2ОН (під дією сірчаної кислоти):
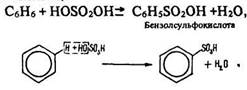
Бензолсульфокислота – сильна кислота. Вона утворює з металами солі, більшість яких розчинна у воді.
Реакції нітрування та сульфування характерні для ароматичних сполук і мають велике практичне значення, оскільки нітро- та сульфопохідні є проміжними продуктами багатьох синтезів.
Правила заміщення в бензольному ядрі. Якщо в бензольному ядрі вже є замісник, тоді інший замісник займає положення, яке залежить від характеру першого. Всі замісники за характером їх спрямовуючої (орієнтуючої) дії можна поділити на дві групи.
Орієнтанти першого роду: Сl–, Вr–, I–, –СН3, –ОН, –NН2 спрямовують нові замісники в орто- і пара-положення. Як правило, ці орієнтанти не містять кратних зв’язків. Усі вони, крім галогенів, полегшують реакції заміщення.
Орієнтанти другого роду
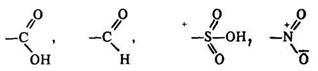
спрямовують нові замісники в метаположення. Для них характерна наявність кратних зв’язків або позитивних зарядів. Замісники другого роду утруднюють реакції заміщення.
Реакції приєднання. Ці реакції відбуваються важче, ніж у ненасичених вуглеводнів. Бензол за високої температури, тиску, наявності каталізаторів і під дією ультрафіолетового опромінювання може виявляти властивості ненасиченої сполуки та приєднувати водень і галогени.
Гідрування бензолу відбувається за температури близько 200 °С, тиску 5066,25 кПа та наявності нікелю або платини:
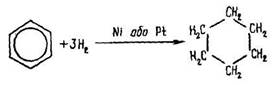
Ця реакція оборотна. За температури близько 300 °С і атмосферного тиску починається процес дегідрогенізації – відщеплення від циклогексану шести атомів водню.
Приєднання галогенів (наприклад хлору) до бензолу відбувається за умов освітлення реакційної суміші сонячним світлом. Під дією ультрафіолетових променів до бензолу приєднується шість атомів хлору і утворюється гексахлорциклогексан:
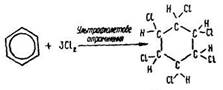
У промислових умовах реакція відбувається в рідкій фазі за температури 15–40 °С в освинцьованих усередині апаратах з ртутно-кварцовими лампами. Гексахлорциклогексан називають ще гексахлораном. Він є отрутохімікатом і як інсектицид широко застосовується для знищення комах-шкідників сільського господарства. Щоб запобігти шкідливій дії отрутохімікатів на навколишнє середовище, необхідно дотримуватися вимог техніки безпеки.
Бензол не приєднує галогеноводні та воду.
Окислення. Бензол дуже стійкий до окисників. На відміну від ненасичених вуглеводнів він не знебарвлює бромну воду та розчин КМnО4. Бензол окислюється киснем. На повітрі він горить кіптявим полум’ям:
2С6Н6 + 3O2 = 12С + 6Н2O
або
2С6Н6 + 15O2 = 12СO2 + 6Н2O.
Хімічні властивості гомологів бензолу. За своїми хімічними властивостями гомологи бензолу дещо відмінні від нього. Так, толуол нітрується легше, ніж бензол. У результаті цієї реакції утворюється 2,4,6-тринітротолуол – вибухова речовина:
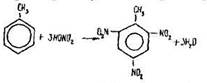
Реакція нітрування толуолу свідчить, що атоми водню в його ядрі заміщуються легше, ніж у бензолі. Це пояснюється впливом групи –СН3, яка як орієнтант першого роду полегшує реакції заміщення в ядрі бензолу. Групи –NO2 спрямовуються в орто- та пара-положення щодо групи –СН3 і в мета-положення один відносно одного. Поряд з цим бензольне ядро впливає на залишок метану –СН3 в молекулі толуолу. Як відомо, метан не окислюється перманганатом калію. У толуолі окислюється вуглець радикалу, зв’язаного з бензольним ядром:
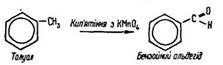
Ці реакції підтверджують положення теорії хімічної будови речовини О. Бутлерова про взаємний вплив атомів і груп атомів у молекулі.
Таким чином, ароматичні вуглеводні можуть вступати у реакції заміщення та приєднання, проте за інших умов, ніж насичені та ненасичені вуглеводні.
Одержання. Бензол та його гомологи одержують з продуктів коксування кам’яного вугілля. З окремих фракцій кам’яновугільної смоли виділяють чисті речовини: бензол, толуол, ксилоли, фенол, нафталін, антрацен та ін. Зараз арени добувають також з нафти. За температури 500 °С, тиску 2533-5066 кПа та наявності каталізаторів відбувається дегідрогенізація циклоалканів:
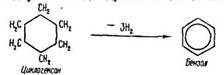
і дегідроциклізація алканів:
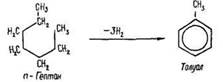
Ця реакція свідчить про існування генетичного зв’язку між різними групами вуглеводнів.
Ароматичні вуглеводні можна добути також шляхом синтезу. За методом М. Зелінського бензол добувають під час пропускання ацетилену крізь трубку з активованим вугіллям за температури 600 °С. При цьому відбувається тримеризація ацетилену (п. 22.7).
Використання. Бензол та його гомологи застосовують для добування нітробензолу, хлорбензолу, барвників, лікарських речовин, отрутохімікатів, високомолекулярних сполук, вибухових і пахучих речовин. Бензол додають до моторного палива, використовують як розчинник.
Важливе значення має похідна сполука бензолу – стирол (або вінілбензол) С6H5–СН=СН2. Це – безбарвна речовина з температурою кипіння 145 °С, яка легко полімеризується (іноді навіть спонтанно). За рахунок нагрівання та застосування ініціаторів (каталізаторів) процес полімеризації відбувається швидко і супроводжується утворенням полістиролу:
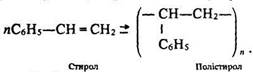
Полістирол – безбарвна тверда пластмаса, що має добрі електроізоляційні властивості. З нього виготовляють електро- та радіодеталі, трубки, крани, посуд тощо. Цю речовину використовують також для виробництва пінопластів.
Стирол легко полімеризується з іншими мономерами. Співполімеризація – це полімеризація, в якій беруть участь два або кілька різних мономерів. Під час співполімеризації стиролу з бутадієном утворюється бутадієнстирольний каучук:
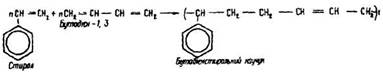
Залежно від співвідношення бутадієну та стиролу під час полімеризації утворюється каучук з різними фізико-хімічними властивостями. Цей каучук міцніший, ніж натрійбутадієновий. Він застосовується для виготовлення автомобільних покришок і камер, різних технічних виробів, ебоніту та ін. Донедавна добування бутадієнстирольного каучуку становило приблизно 30 % світового виробництва синтетичного каучуку.