37. Альдегіди та кетони
Кетони
Визначення. Кетони – це сполуки, молекули яких складаються з двох вуглеводневих радикалів, з’єднаних карбонільною групою >С=О.
Загальна формула кетонів R2CO Радикали (R) можуть бути однаковими і різними (див. табл. 63).
Класифікація. Залежно від виду вуглеводневих радикалів розрізняють аліфатичні (насичені та ненасичені) і ароматичні кетони (див. табл. 63).
Номенклатура. За міжнародною номенклатурою назва кетону складається з назви відповідного вуглеводню і закінчення -он. Під час вибору головного вуглецевого ланцюга слід пам’ятати, що в нього має входити атом вуглецю карбонільної групи, ближче до якого починають нумерацію:
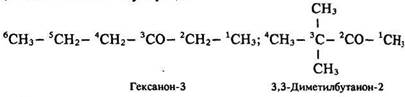
Ізомерія. У кетонів існує ізомерія ланцюга та ізомерія положення карбонільної групи. Так, гексанон-2 і 3,3-диметил-бутанон-2 – ізомери ланцюга, а гексанон-2 і гексанон-3 – ізомери положення карбонільної групи.
Будова молекули. В молекулах кетонів є карбонільна група такої ж електронної будови, як в альдегідах, але біля неї немає атома водню.
Два вуглеводневі радикали кетону більше екранують атом кисню карбонільної групи, ніж атом водню та вуглеводневий радикал альдегіду, що знижує реакційну здатність кетону. Молекули кетонів полярні.
Поширення в природі. Деякі кетони є продуктами метаболізму. Ацетон міститься в сечі хворих на діабет.
Фізичні властивості. За своїми властивостями кетони схожі на альдегіди (див. табл. 63).
Найпростіший кетон (ацетон) – рідина з температурою кипіння 50 °С. Вищі кетони – тверді речовини. Кетони мають запах (деякі – неприємний).
Хімічні властивості. Кетони, як і альдегіди, вступають в реакції відновлення (приєднання водню) і окислення.
Приєднуючи водень за місцем подвійного зв’язку в карбонільній групі, вони відновлюються до вторинних спиртів:
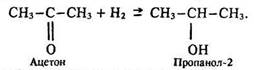
За цією реакцією одержують вторинні спирти.
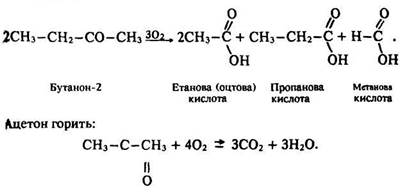
Кетони, не маючи атома водню біля карбонільної групи, окислюються з великими труднощами. Вони не реагують ні з оксидом срібла, ні з гідроксидом міді (II). Під дією сильних окисників (концентрованої азотної кислоти) кетони руйнуються й утворюють кислоти:
Одержання. Ацетон добувають різними способами – сухою перегонкою дерева, розкладом ацетату кальцію, окисленням ізопропілового спирту, гідратацією ацетилену водяною парою. За останнім способом реакція відбувається за температури 400–600 °С і наявності каталізатора, який містить оксиди заліза та марганцю:
![]()
Використання. Ацетон як розчинник застосовується у виробництві штучного шовку, бездимного пороху, кіноплівки, лаків, ліків тощо. Він є вихідною речовиною для синтезу багатьох органічних сполук.