42. Амінокислоти. Білки
Амінокислоти
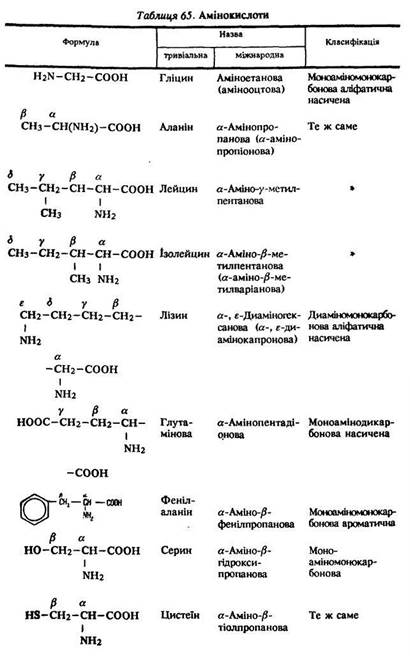
Визначення. Амінокислоти – це органічні кислоти, що містять у вуглеводневому радикалі аміногрупу –NH2. їх загальна формула ![]() . Амінокислоти є прикладом органічних речовин, які мають кілька різних функціональних груп – аміно- та карбоксильну (табл. 65).
. Амінокислоти є прикладом органічних речовин, які мають кілька різних функціональних груп – аміно- та карбоксильну (табл. 65).
Класифікація. Залежно від числа аміно- та карбоксиг- руп розрізняють такі кислоти: моноаміномонокарбонові H2N–R–СООН; диаміномонокарбонові (NН2)2–R–СООН; моноамінодикарбонові H2N–R–(СООН)2, диамінодикарбонові (NН2)2–R–(СООН)2.
За положенням аміногрупи щодо карбоксильної розрізняють альфа-, бета-, гамма-, дельта- та епсилон-амінокислоти (рис. 42).
Вживають також цифрові позначення положення замісників:
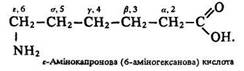
Найбільше біогенетичне значення мають альфа-амінокислоти, з яких побудовані білки, їх загальна формула має такий вигляд:
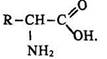
Аміногрупа цих амінокислот знаходиться біля сусіднього з карбоксильним атома вуглецю.
Залежно від природи вуглеводневого радикалу розрізняють аліфатичні, ароматичні, аліциклічні та гетероциклічні амінокислоти. До складу радикалу амінокислот можуть входити різні функціональні групи: гідрокси –ОН, тіо –S–, тіол –SН та ін.
Номенклатура. Багато кислот має тривіальні назви, наприклад гліцин, аланін. За міжнародною номенклатурою назви амінокислот утворюються від назв відповідних карбонових кислот з додаванням префікса аміно- (див. табл. 65).
Ізомерія. Для амінокислот характерна структурна та стереоізомерія. їх структурна ізомерія обумовлена ізомерією вуглецевого ланцюга та положенням аміногрупи щодо карбоксилу (ізомерія положення). Так, лейцин та ізолейцин – ізомери ланцюга, альфа-амінокапронова кислота СН3–СН2–СН2–СН2–СН(NH2)–СООН і епсилон-амінокапронова кислота H2N–СН2–СН2–СН2–СН2–СН2–СООН – ізомери положення аміногрупи.
Стереоізомерія альфа-амінокислот обумовлена просторовою асиметрією атома вуглецю, зв’язаного з чотирма різними групами атомів: R-NН2, –Н, –СООН. Стереоізомери амінокислот виявляють оптичну активність і внаслідок цього називаються оптичними. Природні альфа-амінокислоти є лівообертаючими ізомерами.
Будова молекули. Молекули амінокислот містять дві функціональні групи з протилежними хімічними властивостями – аміногрупу – з основними та карбоксильну – з кислотними. Ці дві групи, знаходячись в одній молекулі, взаємодіють між собою з утворенням внутрішньої солі
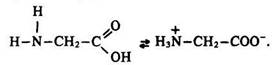
Молекула амінокислоти є біполярним іоном. Цим пояснюються фізичні та хімічні властивості амінокислот.
Поширення в природі. Амінокислоти в природі існують у вільному стані та в складі інших сполук. Подібно до того, як із молекул глюкози побудовані високомолекулярні природні вуглеводи – крохмаль та целюлоза, із молекул амінокислот утворені всі рослинні та тваринні білки. Відмінність полягає лише в тому, що у крохмалю та целюлози мономером є одна речовина – глюкоза, а до складу кожного білка входять різні амінокислоти. Білки містять 26 амінокислот, найчастіше трапляються 22 з них.
Амінокислоти відіграють важливу роль в обміні азотовмісних сполук у живих організмах. З них утворюються необхідні для життєдіяльності речовини: білки, пептиди, ферменти, гормони тощо.
Амінокислоти, які можуть синтезуватися в організмі тварин і людини з інших амінокислот або небілкових компонентів, називаються замінними (гліцин, серин, глутамінова кислота), а ті, що не синтезуються, але є необхідними для життєдіяльності – незамінними (лізин, лейцин, ізолейцин, фенілаланін). Відомо дев’ять незамінних амінокислот. Вони синтезуються лише в зелених рослинах.
Фізичні властивості. Амінокислоти – це безбарвні нелеткі кристалічні, оптично активні речовини з температурами плавлення більшими, ніж у амінів і карбонових кислот, розчинні у воді. Багато з них є солодкими на смак.
Властивості амінокислот обумовлені будовою їх молекул – утворенням біполярного іона.
Хімічні властивості.
Амфотерність. Амінокислоти виявляють подвійну хімічну функцію: основну та кислотну, тобто вони є амфотерними органічними сполуками. Від неорганічних амфотерних сполук вони відрізняються тим, що їх кислотні та основні властивості обумовлені різними групами.
Розчини амінокислот, які містять у молекулах однакове число аміно- та карбоксигруп, нейтральні і не впливають на забарвлення індикаторів. Розчин моноамінодикарбонової кислоти мас кислу реакцію (змінює колір індикаторів як кислота), а диаміномонокарбонової – лужну (змінює колір індикаторів як луг).
Кислотні властивості. За наявності лугів амінокислоти виявляють звичайні властивості кислот і утворюють солі:
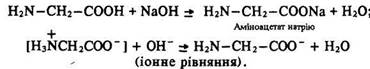
Амінокислоти взаємодіють з металами та основними оксидами з утворенням солей.
Із спиртами амінокислоти подібно до неорганічних та органічних кислот утворюють естери:
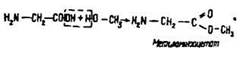
Основні властивості Амінокислоти виявляють властивості органічних основ і з сильними мінеральними кислотами утворюють солі:
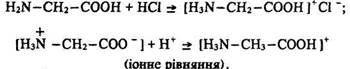
Поліконденсація. Для амінокислот характерні реакції поліконденсації з утворенням поліпептидів:
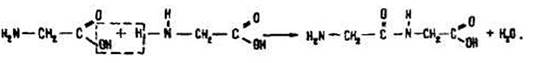
В результаті цієї реакції утворюється група атомів –СONH–, яка називається пептидною, або амідною, а зв’язок між атомами вуглецю та азоту в ній – пептидним (амідним). Речовини, які містять пептидні групи – поліпептиди.
Під час взаємодії двох молекул амінокислот утворюються дипептиди, трьох – трипептиди, чотирьох – тетрапептиди:
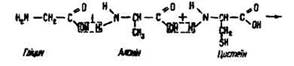
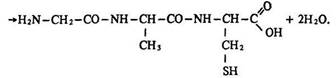
За допомогою пептидних зв’язків залишки амінокислот сполучаються і утворюють молекули білків. Так спрощено можна уявити синтез білків, що відбувається в живих організмах.
Під час конденсації епсилон-амінокапронової кислоти утворюється полімер капрон:
1) одержання галогенозаміщеної карбонової кислоти:
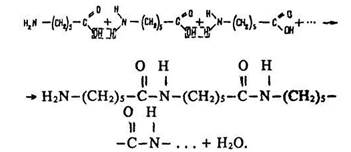
Макромолекули капрону мають лінійну структуру. їх будову можна зобразити формулою:
![]()
Молекулярна маса макромолекул становить 16–22 тис. Капрон витягують у волокно, яке не поглинає воду, не втрачає міцність, не гниє у вологому стані і не псується міллю. Воно більш стійке до стирання, ніж усі натуральні волокна. Висока міцність капрону обумовлена утворенням численних водневих зв’язків між його макромолекулами в результаті взаємодії груп –NН– та –СО–.
Але капрон має також істотні недоліки – його молекули гідролізуються під дією кислот в місцях амідних зв’язків, за температури 215 °С він плавиться.
Одержання. Амінокислоти добувають гідролізом білків (подібно до того, як глюкозу одержують гідролізом високомолекулярних вуглеводнів). Один із синтетичних способів добування амінокислот складається з двох стадій:
1. одержання галогензаміщеної карбонової кислоти
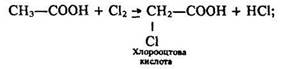
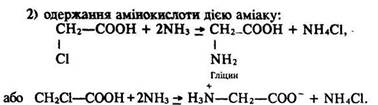
Використання. Амінокислоти застосовують у медицині, а також для годівлі тварин, як вихідні речовини для добування пластмас та штучних волокон.
З капронового волокна виготовляють одяг, штучне хутро, парашути, канати, рибальські сітки. З особливо міцного капрону виробляють кордову тканину для авто- та авіапокришок, деталі машин і приладів.