31. Алкадієни
Алкадієни
Визначення. Дієнові вуглеводні – сполуки з двома подвійними зв’язками. Вони утворюють гомологічний ряд вуглеводнів, склад яких описується загальною формулою СnH2n–2, де n > 4.
Номенклатура. Вживається ще така загальна назва дієнових вуглеводнів: алкадієни. Назви окремих речовин утворюються додаванням до назви алканів закінчення -дієн (табл. 57).

Ізомерія. Для алкадієнів характерна структурна ізомерія (обумовлена положенням подвійних зв’язків або розгалуженням ланцюга вуглецевих атомів) і стереоізомерія. Ізомерія бутадієну- 1,2, бутадієну-1,3, пентадіену-1,2, пентадієну-1,3 і пентадієну- 1,4 спричинена зміною положення подвійних зв’язків, а 2-метилбутадієну-1,3 – розгалуженням вуглецевого ланцюга.
Будова молекули. Взаємне розміщення подвійних зв’язків може бути різним (див. табл. 57). Велике практичне значення мають алкадієни, в молекулах яких подвійні зв’язки розділені простим зв’язком (вуглеводні зі спряженою системою подвійних зв’язків). Найважливішими з них є дивініл та ізопрен (див. табл. 57).
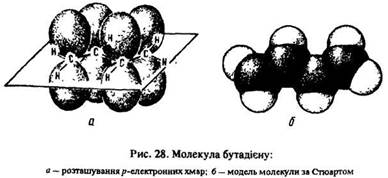
У молекулі дивінілу всі атоми розміщені в одній площині:
![]()
Як бачимо, простий зв’язок (між другим і третім атомами вуглецю), розміщений між подвійними, має довжину 0,146 нм. За довжиною він посідає проміжне положення між простим в алканах (0,154 нм) і подвійним в алкенах (0,133 нм). Це обумовлено тим, що хмари р-електронів, розташовані перпендикулярно до площини молекул, взаємодіють між собою і утворюють спільну p-електронну хмару (рис. 28). Цей процес називається спряженим і призводить до вирівнювання зв’язків:
![]()
Фізичні властивості. Дивініл – безбарвний газ, кипить за температури –5 °С. Ізопрен – безбарвна рідина, температура кипіння 34 °С.
Хімічні властивості.
Реакції приєднання. Алкадієни, як і алкени, вступають у реакції приєднання з галогенами (знебарвлюють бромну воду) і галогеноводнями. Але реакції приєднання у вуглеводнів зі спряженими подвійними зв’язками мають свої особливості.
Залежно від умов можуть утворюватися різні продукти: за низьких температур – 3,4-дибромбутен-1:
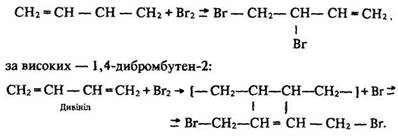
За високих температур у молекулі алкадієну одночасно розриваються два подвійних зв’язки і приєднуються до першого і четвертого атомів вуглецю, а між другим і третім утворюється подвійний зв’язок.
Таким чином, у результаті реакції приєднання в молекулі вуглеводню переміщується подвійний зв’язок.
У разі надлишку брому відбувається повне насичення вуглеводню:
![]()
Полімеризація. Алкадієни досить легко полімеризуються. Внаслідок цього утворюються каучукоподібні полімери:
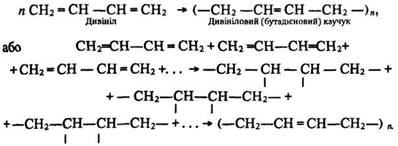
Натуральний каучук. Натуральний каучук – високоеластичний матеріал рослинного походження, його добувають з латексу – молочного соку деяких тропічних рослин, наприклад гевеї. Батьківщиною гевеї є Бразилія. Латекс є водним колоїдним розчином каучуку. Під час нагрівання або дії кислоти він коагулює. Каучук, який утворюється, відокремлюють від рідини та сушать. Розчиняється каучук у бензині, бензолі та сірковуглеці. Найважливіші властивості каучуку – еластичність і водо- та газонепроникність. Натуральний каучук є природним полімером ізопрену. Це високомолекулярний ненасичений вуглеводень, склад якого описується формулою (С5Н8)n, де n дорівнює в середньому 2500. Молекулярна маса природного каучуку становить приблизно 150000–500000. Під час утворення молекул каучуку ізопрен полімеризується в довгі ланцюги такої будови:
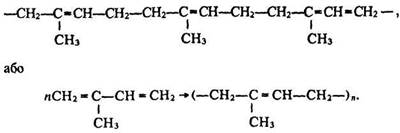
Макромолекула каучуку має лінійну структуру, як і поліетилен, однак характеризується набагато більшою еластичністю. Ця властивість каучуку пояснюється так. Молекули натурального каучуку мають стереорегулярну будову – метиленові групи –СН2– знаходяться в цис-положенні, тобто розташовані з одного боку від подвійного зв’язку:
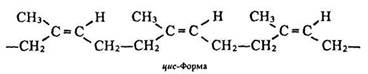
Стереорегулярна будова полімерів – це закономірне чергування в їх макромолекулах ланок однакової або різної конфігурації.
Молекули каучуку не витягнуті в лінію, а сильно вигнуті, ніби згорнуті в клубки. Під час розтягування вони розпрямляються і шматок каучуку стає довшим. Якщо навантаження зняти, внаслідок внутрішнього теплового руху ланок молекули повертаються до попереднього стану – розміри каучуку зменшуються.
Синтетичні каучуки. Природних ресурсів каучуку недостатньо для задоволення швидко зростаючих потреб промисловості. Тому виникла необхідність його штучного добування.
Такий каучук називають натрійбутадієновим. З нього виготовляють шини, взуття, ізоляційні матеріали.
Колишній Радянський Союз – перша країна світу, в якій було розпочато виробництво синтетичного каучуку. В 1932 р. вчений С. Лебедев (1874–1934) запропонував метод добування бутадієнового каучуку полімеризацією бутадієну (СН2=СН–СН=СН2) за наявності каталізатора – металічного натрію (Т > 60°С, р = 608–709 кПа). Структурна ланка макромолекули полімеру бутадієнового каучуку має таку формулу:
![]()
Оскільки цей каучук не має стереорегулярної будови, він не такий еластичний і міцний, як натуральний.
Зараз розроблено метод добування ізопренового каучуку стереорегулярної будови, який за своїми властивостями практично не відрізняється від натурального. Його використовують для виготовлення шин.
Хлоропреновий каучук добувають полімеризацією хлоропрену:
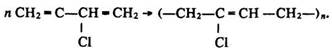
Він стійкий до дії світла, масел і розчинників, тому його використовують для виготовлення деталей машин і приладів.
Промисловість виробляє також інші каучуки (бутадієнстирольний, бутилкаучук), які за деякими властивостями кращі, ніж натуральний.
Каучуки внаслідок нагрівання розм’якшуються, стають липкими, а внаслідок охолодження – крихкими і жорсткими. Ці недоліки усувають вулканізацією. Вулканізацією називають процес перетворення каучуку на гуму під час його нагрівання з сіркою. Сірка приєднується до полімера в місцях розриву подвійних зв’язків, «зшиваючи» молекули каучуку:
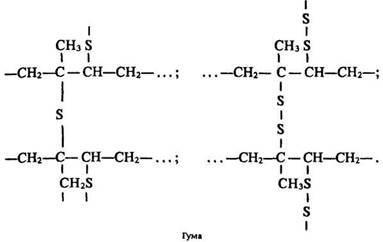
Гума – наповнений полімер, що має просторову будову. Гума більш еластична та стійка до зміни температури і дії розчинників (нерозчинна в бензині), ніж невулканізований каучук. Це пояснюється тим, що в гумі між лінійними макромолекулами, крім міжмолекулярних сил, існують також сили хімічних зв’язків (рис. 29). Каучук з масовою часткою сірки до 32 % називають ебонітом. Ебоніт – тверда речовина, з властивостями ізолятора.

Каучук має таке ж велике народногосподарське значення, як нафта, сталь, кам’яне вугілля. Багато його використовується в автомобільній, авіаційній, електротехнічній промисловості, медицині.