36. Фенол. Етери
Фенол
Визначення. Фенол – це гідроксипохідне бензолу, в молекул, якого гідроксигрупа безпосередньо зв'язана о атомом вуглецю бензольного ядра. Його формула С6Н5ОН.

Класифікація. Фенол належить до класу одноатомних фенолів, які залежно від числа гідроксигруп бувають одно-, дво- або триатомними (див. табл. 62). Одноатомні феноли утворюють гомологічний ряд з загальною формулою R–С6Н4OН, де R – вуглеводневий радикал. Крезол СН3–С6Н4ОН – найближчий гомолог фенолу.
Номенклатура. Вживаються такі назви фенолу: гідроксибензол, карболова кислота.
Ізомерія. Для фенолів характерна структурна ізомерія положення замісників у ядрі (о-, м-, п- крезоли) та міжкласовз ізомерія з ароматичними спиртами (табл. 62).
Будова молекули. У фенолі гідроксигрупа безпосередньо зв'язана з бензольним ядром, яке виявляє негативний індукційний ефект (рис. 34). Вільна електронна пара атома кисню вступає у взаємодію з пі-електронною системою бензольного ядра, частина електронної густини зміщується від кисню у зв’язку С<–О, а кисень міцніше притягує до себе електронну пару зв’язку О<–Н. Тому у фенолі водень гідроксигрупи більш рухливий, ніж у аліфатичних або ароматичних спиртах, отже він виявляє сильніші кислотні властивості. Разом з тим, гідроксигрупа як орієнтант першого роду впливає на бензольне ядро, перерозподіляючи його електронну густину, внаслідок чого атоми водню бензольного ядра в положеннях 2,4,6 (орто- та пара-) стають рухливішими. Феноли легше вступають у реакції заміщення, ніж бензол.
Порівняно зі спиртами молекули фенолів більш полярні і тому водневі зв’язки між ними міцніші, що впливає на їх фізичні та хімічні властивості.
У вільному стані фенол у природі не існує.
Фізичні властивості. Фенол – безбарвна, тверда, кристалічна речовина з різким характерним запахом. Під час зберігання він постійно окислюється киснем повітря і набуває рожевого забарвлення. Ця речовина має більш високі температури – плавлення (42,3 °С) і кипіння (182 °С), ніж спирти (С1–С15). У воді він розчиняється частково (в 100 г води – 6 г фенолу за звичайних умов), що пояснюється впливом гідрофобного ароматичного радикалу.
Фенол має сильні антисептичні властивості, тобто здатність вбивати мікроорганізми. Він є досить отруйним – обпалює шкіру, спричинюючи водянки та виразки.
Хімічні властивості. Фенол вступає в хімічні реакції, обумовлені гідроксигрупою та ароматичним ядром.
Кислотні властивості. Фенол виявляє властивості кислоти, слабшої за вугільну (К = 10–10), але сильнішої за спирти. Його водні розчини містять достатню кількість іонів водню, щоб змінити колір індикаторів (наприклад, метилоранж набуває червоного забарвлення):
![]()
![]()
Фенол легко взаємодіє не лише з металічним натрієм, але й з лугами, утворюючи солі – феноляти (порівняйте з властивостями аліфатичних одноатомних спиртів):
Феноляти гідролізуються в розчини (реакція розчину лужна) і розкладаються мінеральними кислотами, навіть вугільною:
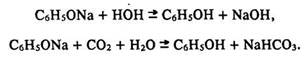
Взаємодія з формальдегідом. Фенол реагує з формальдегідом за реакцією поліконденсації і утворює фенол-формальдегідні смоли. Цю реакцію буде розглянуто в розділі, де наведені властивості альдегідів.
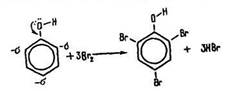
Взаємодія з бромною водою. На відміну від бензолу фенол утворює з бромною водою 2,4,6-трибромфенол:
Одержання. Для промислових потреб фенол добувають з кам’яновугільної смоли за допомогою лугу та мінеральної кислоти за схемою:
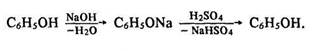
У великих кількостях його одержують також синтетичним способом з бензолу за схемою:
![]()
![]()
Використання. Фенол застосовують для виробництва лікарських речовин, фенолo-формальдегідних смол, фотографічних проявників і барвників, а також як сильний антисептик і антиоксидант.
Фенол, що міститься у відходах багатьох промислових виробництв, дуже шкодить навколишньому середовищу, оскільки є небезпечним для тварин і рослин. Щоб запобігти забрудненню повітря та води фенолом, застосовують безвідхідні технологічні процеси, в яких гази, що містять фенол, піддають каталітичному окисленню, стічні води обробляють озоном, а фенол видаляють розчинниками.