7. ХІМІЧНІ РЕАКЦІЇ
7. ХІМІЧНІ РЕАКЦІЇ
7.4. Термохімічні розрахунки
В основі усіх термохімічних розрахунків лежить закон Гесса, сформульований у 1858 р. російським хіміком В. Гессом:
Тепловий ефект хімічної реакції визначається лише природою і агрегатним станом реагентів і не залежить від шляху проходження процесу (або від кількості проміжних стадій).
Пояснимо це на прикладі.
Добути карбон (ІV) оксид можна двома шляхами (рис. 7.1):
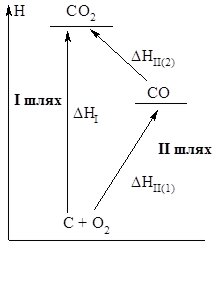
Рис. 7.1. Ентальпійна діаграма утворення СО2
- В одну стадію – взаємодією простих речовин вуглецю та кисню у співвідношенні 1 : 1 (І шлях).
- У дві стадії – взаємодією простих речовин вуглецю та кисню у співвідношенні 2 : 1 (1 стадія) і наступним спалюванням одержаного карбон (ІІ) монооксиду в надлишку кисню (2 стадія) (ІІ шлях):
С(гр) + О2(г) = СО2(г), ΔНІ = – 393,5 кДж/моль – І шлях
2С(гр) + О2(г) = СО(г), ΔНІІ(1) = – 110,5 кДж/моль – ІІ шлях (1 стадія)
СО(г) + ½О2(г) = СО2(г), ΔН ІІ(2) = – 283 кДж/моль – ІІ шлях (2 стадія)
Як видно з рис. 7.1., у результаті реакцій за двома напрямками, кінцевий тепловий ефект однаковий:
ΔНІ = ΔНІІ(1) + ΔНІІ(2) = ‑ 110,5 кДж/моль+ (‑ 283 кДж/моль) = ‑ 393,5 кДж/моль
Із закону Гесса випливає кілька наслідків:
1. Тепловий ефект хімічної реакції рівний різниці між сумами стандартних теплот утворення продуктів реакції і реагентів (І наслідок):
ΔНх.р. = ΣНпрод. – ΣНреагенти.
2. Тепловий ефект хімічної реакції рівний різниці між сумами стандартних теплот згоряння реагентів і продуктів реакції (ІІ наслідок):
ΔНх.р. = ΣНзгор. регенти. – ΣНзгор. прод.
Стандартна теплота утворення речовини (ΔНf0) (англ. formation – утворення) – тепловий ефект реакції утворення 1 моль сполуки з простих речовин, стійких за стандартних умов:
Н2(г) +О2(г) = Н2О(г), ΔН f0 = –286 кДж
Стандартні теплоти утворення різних сполук наведені у довідниках. Теплоти утворення простих речовин приймаються рівними нулю (крім алмазу, озону та деяких інших алотропних модифікацій).
Стандартна теплота згоряння (ΔН0згор) – тепловий ефект згоряння 1 моль речовини у достатній кількості кисню О2:
NH3(г) + 3/4O2(г) = ½N2(г) + 3/2H2O(г), ΔН0згор = – 383 кДж
Теплоти згоряння вищих оксидів рівні нулю.