11. РОЗЧИНИ
11. РОЗЧИНИ
11.2. Розчинення речовин. Кристалогідрати
Розчинення – процес рівномірного розподілу частинок розчиненої речовини в об’ємі розчину. Розчинення – самовільний процес.
Перехід речовини у розчин супроводжується поступовим збільшенням її концентрації. Зворотний процес – виділення речовини з розчину – кристалізація. На початку процесу утворення розчину переважає процес розчинення, а у певний момент настає динамічна рівновага між розчиненням і кристалізацією.
Розчинення не можна розглядати як механічний процес, оскільки властивості розчинника і розчинених речовин у розчині змінюються. Про це свідчать такі факти:
- Об’єм розчину ніколи не дорівнює сумі об’ємів окремо взятих компонентів – “контракція” (500 мл води + 500 мл етанолу = 940 мл);
- Зміна температури при розчиненні (NH3 + H2O – охолодження, H2SO4 + H2O – розігрівання);
- Зміна забарвлення (білий CuSO4 і безбарвна H2O утворюють розчин блакитного кольору).
Ці явища зумовлені фізичними та хімічними факторами. Вплив їх пояснюють відповідно фізична та хімічна теорії утворення розчинів.
Прихильники фізичної теорії (Я. Вант-Гофф, В. Оствальд, Ф. Рауль) розглядали процеси розчинення як фізичне явище. Розподіл молекул розчиненої речовини між молекулами розчинника відбувається за рахунок дифузії, при цьому будь-яка міжмолекулярна взаємодія виключена.
Хімічна теорія розчинення (Д.І. Менделєєв, І.А. Каблуков, М.С. Курнаков) передбачала хімічну взаємодію між молекулами розчинника і розчиненої речовини, яка веде до утворення більш-менш стійких продуктів.
Фізична та хімічна теорії лягли в основу сучасної фізико-хімічної теорії утворення розчинів, яка враховує фізичні та хімічні процеси при розчиненні. Фізичними явищами є розподіл молекул розчиненої речовини між молекулами розчинника шляхом дифузії і взаємодія між ними за рахунок електростатичних сил: диполь-дипольна, міжіонна тощо.
Фізичні сили діють на великих відстанях і передують хімічним, які починають діяти на відстані діаметра молекули і перебудовують електронні оболонки атомів або іонів.
Сукупність фізичних та хімічних процесів взаємодії розчиненої речовини з розчинником називають сольватацією (у випадку, коли розчинником є вода – гідратацією). Сполуки змінного складу, що утворюються у процесі сольватації називають сольватами (у випадку води – гідратами).
Розглянемо сутність процесу утворення розчину на прикладі розчинення твердої речовини у рідині (NaCl у Н2О).
NaCl – кристалічна іонна сполука, у водному розчині існують іони Na+ та Cl–. Між молекулами води діють водневі зв’язки і сили Ван-дер-Ваальса. Процес розчинення починається з орієнтації диполів води відносно кристалічної гратки NaCl. Між розміщеними на поверхні кристалу NaCl іонами Na+ та Cl– та диполями води виникає іон-дипольна взаємодія. Диполі води орієнтуються так, що до іонів Na+ вони обертаються негативним, а до іонів Cl– – позитивним полюсом. Внаслідок взаємодії з диполями води іони Na+ та Cl– вириваються з поверхні кристала, гідратуються і дифундують в розчинник. Кристал NaCl розпадається на гідратовані іони, які утворюють з водою гомогенну систему – іонний розчин (рис. 11.1).
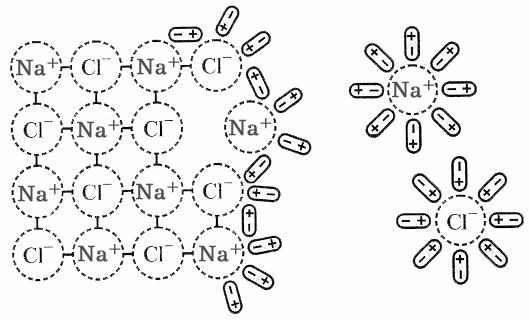
Рис. 11.1. Схема розчинення NaCl у воді.
Іноді гідратна вода настільки міцно зв’язана з розчиненою речовиною, що при виділенні речовини з розчину виходить до складу її кристалів.
Кристалічні речовини, до складу яких входить вода називають кристалогідратами, а воду у їх складі – кристалізаційною.
Склад кристалогідратів виражають, вказуючи у формулі кількість молекул кристалізаційної води, що припадає на одну молекулу речовини. Так, запис CuSO4∙5H2O означає, що в кристалогідраті на одну молекулу CuSO4 припадає 5 молекул H2O, а запис 2CаSO4∙H2O або CаSO4∙0,5H2O – на одну молекулу Н2О припадає 2 молекули CаSO4.
Деякі речовини утворюють кристалогідрати з різною кількістю молекул води. Так, CoCl2 утворює кристалогідрати складу CoCl2∙хН2О, де х = 1, 2, 4 або 6. Залежно від кількості молекул кристалізаційної води змінюється забарвлення кристалогідрату. Розчин CoCl2 – рожево-червоного кольору (гідратовані іони Co2+), кристалогідрат CoCl2∙6Н2О – рожево-червоний, CoCl2∙4Н2О – рожевий, CoCl2∙2Н2О – синьо-фіолетовий, CoCl2∙Н2О – темно-синій, CoCl2 – блідо-синій.
Більшість кристалогідратів – сполуки нестійкі і легко втрачають кристалізаційну воду. Na2CO3∙10Н2О втрачає воду при 20 0С, Na2SO4∙10Н2О – при 32 0С, СuSO4∙5Н2О – при тривалому нагріванні.