12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
12.5. Константа дисоціації
Поділ електролітів на сильні та слабкі в залежності від ступеня дисоціації є умовним, оскільки величина a залежить від багатьох факторів (див. ступінь дисоціації) і може змінюватись у широких межах. Тому з цією метою використовують константу іонізації (дисоціації).
Запишемо схему дисоціації електроліту загальної формули KtAn:
KtAn ↔ Kt+ + An–
Константа рівноваги цього процесу, згідно із законом дії мас, описується рівнянням:
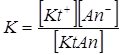
Константа іонізації (дисоціації) К – константа рівноваги процесу дисоціації електроліту.
Константа дисоціації слабких електролітів залежить від температури, природи електроліту, розчинника і не залежить від концентрації.
Чим більше значення К, тим сильніше дисоціює електроліт, і тим сильнішою є відповідна кислота або основа.
Якщо електроліт дисоціює ступінчато, то Кі визначають для кожного ступеня, а загальне значення К дорівнює добутку ступінчатих Кі:
Н3РО4 ↔ Н+ + Н2РО4– ; 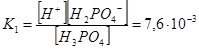
Н2РО4– ↔ Н+ + НРО42–; 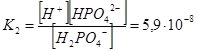
НРО42– ↔ Н+ + РО43– ; 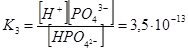
Н3РО4 ↔ 3Н+ + РО43– ; 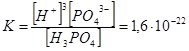
Як бачимо, Н3РО4 максимально дисоціює за першим ступенем і у цьому випадку є сильною кислотою. На кожній наступній стадії дисоціація відбувається у меншій мірі, і тому у розчинах фосфатної кислоти містяться молекули Н3РО4, катіони Н+ та аніони Н2РО4–, НРО42–, РО43–. Кількість кожного наступного компонента поступово зменшується.
Для зручності запису, використовують не абсолютні значення К, а їх десяткові логарифми зі знаком “–”:
–lg K = pK
рК – показник сили електроліту. Якщо ввести індекси а – кислота (англ. acid – кислота), а b – основа (англ. basis – основа), то рКа – показник кислотності, рКb – показник основності (табл. 12.4).
Таблиця 12.4
Значення Кх та рКх деяких слабких кислот та основ
|
Електроліт |
Формула |
Кх |
рКх |
|
Кислоти |
|||
|
Карбонатна |
Н2СО3 |
Ка1 = 4,5∙10–7 Ка2 = 4,7∙10–11 |
рКа1 = 6,35 рКа2 = 10,33 |
|
Нітритна |
HNO2 |
Ка1 = 4,0∙10–4 |
рКа1 = 3,40 |
|
Сульфітна |
H2SO3 |
Ка1 = 1,6∙10–2 Ка2 = 1,6∙10–8 |
рКа1 = 1,80 рКа2 = 7,21 |
|
Сульфідна |
H2S |
Ка1 = 1,0∙10–7 Ка2 = 2,5∙10–13 |
рКа1 = 6,99 рКа2 = 12,60 |
|
Мурашина |
HCOOH |
Ка1 = 1,8∙10–4 |
рКа1 = 3,74 |
|
Оцтова |
CH3COOH |
Ка1 = 1,8∙10–5 |
рКа1 = 4,75 |
|
Основи |
|||
|
Амоніак (водн. розчин) |
NH3∙H2O |
Кb1 = 1,8∙10–5 |
рКb1 = 4,75 |
|
Алюміній гідроксид |
Al(OH)3 |
Кb3 = 1,4∙10–9 |
рКb3 = 8,86 |
|
Ферум (ІІ) гідроксид |
Fe(OH)2 |
Кb2 = 1,3∙10–4 |
рКb2 = 3,89 |
|
Ферум (ІІІ) гідроксид |
Fe(OH)3 |
Кb2 = 1,8∙10–11 Кb3 = 1,4∙10–12 |
рКb2 = 10,74 рКb2 = 11,87 |
Порівнюючи значення рКа, наприклад, для нітритної HNO2 та сульфітної H2SO3 кислот, бачимо, що H2SO3 за першим ступенем дисоціації сильніша, ніж HNO2, а за другим – слабкіша. Аналогічно алюміній гідроксид Al(OH)3 сильніша основа, ніж ферум (ІІІ) гідроксид Fe(OH)3.
Зауважимо, що при наявності у розчині одночасно кількох кислот або основ різної сили, у реакцію, наприклад, нейтралізації, спочатку буде вступати електроліт з найменшим значенням рКх, і далі у порядку зростання рКх. Так, коли у розчині одночасно присутні H2SO3 і HNO2, при додаванні NaOH, спочатку реагує H2SO3 за першим ступенем, потім HNO2, і, нарешті, H2SO3 за другим ступенем (табл. 12.4):
H2SO3 + NaOH = NaHSO3 + H2O;
HNO2 + NaOH = NaNO2 + H2O;
NaHSO3 + NaOH = Na2SO3 + H2O.
Легко показати зв’язок між К та a для слабкого електроліту, наприклад мурашиної кислоти НСООН, яка дисоціює за схемою:
НСООН + Н2О ↔ Н3О+ + НСОО–
Запишемо Ка цього процесу:
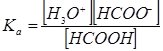
Зі схеми дисоціації видно, що [Н3О+] = [НСОО–] = αНСООНСНСООН, а [НСООН] = СНСООН – αНСООНСНСООН = (1 – αНСООН)СНСООН.
Підставивши одержані значення в рівняння для Ка, одержимо:
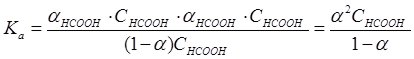
Оскільки у розчинах слабких електролітів значення α дуже мале, то 1 ‑ α » 1, тому Ка = α2СНСООН і ![]() .
.
Наведена формула – математичний вираз закону розведення Оствальда, і показує, що зі зростанням концентрації С електроліту, ступінь дисоціації α зменшується.
Використовуючи дану формулу можна обчислити [Н+] і [ОН–] в розчинах слабких одноосновних кислот та однокислотних основ відповідно. Для прикладу, виведемо формулу для розрахунку [Н+] у розчині мурашиної кислоти НСООН.
Враховуючи, що [Н+] = [ НСОО–], і оскільки НСООН – слабка кислота, то вона у розчині дисоціює незначною мірою, а тому часткою дисоційованих молекул НСООН можна знехтувати, і [НСООН] = СНСООН:
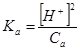 , [Н+]2 = КаСа або [Н+] =
, [Н+]2 = КаСа або [Н+] = ![]() .
.
Аналогічно можна довести, що для слабкої основи [ОН–] = ![]() .
.