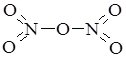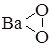13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13.3. Оксиди
Серед складних неорганічних речовин виділяють оксиди, гідроксиди, кислоти, солі та комплексні сполуки.
Оксиди – складні речовини, що складаються з двох елементів, один з яких Оксиген у ступені окиснення –2. В оксидах не існує зв’язку між атомами Оксигену. Сполуки, у яких є такий зв’язок, називають пероксидами, ступінь окиснення Оксигену у них –1, їх відносять до класу солей гідроген пероксиду Н2О2 (табл. 13.5).
Хімічну (систематичну назву) оксидів складають з двох слів: перше – назва елемента у називному відмінку, друге – оксид. Якщо елемент може утворювати кілька оксидів, то у назві оксиду, після назви елемента вказують у дужках його ступінь окиснення (римською цифрою, без знаків “–” чи “+”). Іноді оксиди складу ЕО називають монооксидами, ЕО2 – діоксидами тощо. Деякі оксиди мають тривіальні назви (табл. 13.5).
Таблиця 13.5
Деякі бінарні сполуки елементів з Оксигеном
|
Формула |
Графічна формула |
Назва |
|
Н2О |
|
гідроген оксид, вода |
|
СО2 |
|
карбон (IV) оксид, карбон діоксид, вуглекислий газ |
|
N2O5 |
|
нітроген (V) оксид, нітроген пентаоксид, нітратний ангідрид |
|
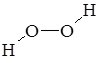
Н2О2 |
|
гідроген пероксид |
|
BaO2 |
|
барій пероксид |
Основні способи одержання оксидів
- Взаємодія простих речовин з киснем, що супроводжується виділенням тепла і світла – горіння:
а) металів: 4Al + 3O2 = Al2O3; 2Сu + O2 = 2CuO;
Таким способом неможливо одержати оксиди лужних металів, які при взаємодії з киснем утворюють пероксиди або надпероксиди (супероксиди):
2Na + O2 = Na2O2, К + O2 = КO2,
тому оксиди таких елементів одержують іншими методами:
Na2O2 + 2Na = 2Na2O; 4КO2 = 2К2O + 3O2
б) неметалів: 2Н2 + O2 = 2Н2O; С + О2 = СО2.
2. Взаємодія складних речовин з киснем:
а) неорганічних: 2H2S + 3O2 = 2H2O + 2SO2; 2SO2 + O2 = 2SO3;
б) органічних: СН4 + 2O2 = СО2 + 2Н2O; С2Н5ОН + 3O2 = 2СО2 + 3Н2O.
3. Термоліз складних речовин:
а) оксидів: 2PbO2 = 2PbO + O2; 2N2O5 = 4NO2 + O2;
а) гідроксидів: Сu(OH)2 = CuO + H2O; 2Fe(OH)3 = Fe2O3 + 3H2O;
а) кислот: 4НNO3 = 4NO2 + 2H2O + O2; H2SO3 = SO2 + H2O;
а) солей: СаСO3 = СаO + СO2; NH4NO3 = N2O + 2H2O;
Існують специфічні способи добування деяких оксидів, їх розглянуто при вивченні відповідних елементів.
Класифікація оксидів
Усі оксиди поділяють на солетвірні і несолетвірні (індиферентні) (схема 13.1).
Несолетвірні (індиферентні) оксиди не утворюють солей у реакціях з кислотами і основами. Таких оксидів 4: карбон (ІІ) оксид СО, силіцій (ІІ) оксид SiO, нітроген (І) оксид N2O, нітроген (ІI) оксид NO. Однак, відомий спосіб одержання натрій форміату базується на реакції:
СО + NaOH = HCOONa (тиск 15 атмосфер).
Солетвірні оксиди у реакціях з кислотами або основами утворюють солі:
СаО + H2SO4 = CaSO4 + H2O; CO2 + 2NaOH = Na2CO3 + H2O.
Серед солетвірних виділяють основні, кислотні та амфотерні оксиди.
Основні – оксиди, гідрати яких – основи. Основними є оксиди лужних (Li, Na, K) і лужноземельних (Ca, Sr, Ba) металів, а також оксиди Cu (II), Fe (II) та Fe (III). У них переважно реалізується іонний хімічний зв’язок, за н. у. усі вони – тверді речовини.
Фізичні властивості оксидів
За н.у. оксиди перебувають у газоподібному (N2O, CO2), рідкому (H2O, SO3) або твердому (оксиди металів) стані.
Хімічні властивості основних оксидів
1. Взаємодія з водою з утворенням лугів:
Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Оксиди Cu (II), Fe (II) та Fe (III) з водою не взаємодіють.
2. Взаємодія з кислотами з утворенням солей та води:
Li2O + 2HCl = 2LiCl + H2O; СuO + H2SO4 = CuSO4 + Н2О.
3. Взаємодія з кислотними та амфотерними оксидами з утворенням солей:
K2O + CO2 = K2CO3; Na2O + Al2O3 = 2NaAlO2;
FeO + SO3 = FeSO4; BaO + ZnO = BaZnO2.
4. Взаємодія з амфотерними гідроксидами з утворенням солей та води:
Na2O + Al(OН)3 = 2NaAlO2 + 3Н2О.
5. Участь в окисно-відновних реакціях:
Fe2O3 + 2Al = Al2O3 + 2Fe; 3CuO + 2NH3 =3Cu + N2 + 3H2O.
Кислотні – оксиди, гідрати яких – кислоти. Ці оксиди ще називають ангідридами кислот. Кислотними є оксиди неметалів та металів у високих (+5 – +7) ступенях окиснення. В кислотних оксидах реалізується ковалентний полярний хімічний зв’язок, за н.у. вони перебувають у газовому (СО2, SO3), рідкому (N2O5, Cl2O7) або твердому (Р2О5, Mn2O7) стані.
Хімічні властивості кислотних оксидів.
1. Взаємодія з водою з утворенням кислот:
SO3 + H2O = H2SO4; P2O5 + 3H2O = 2H3PO4.
Кислотні оксиди, утворені елементами, що перебувають у проміжному ступені окиснення у цьому випадку утворюють дві кислоти:
2N+4O2 + H2O = HN+3O2 + HN+5O3; 2Cl+6O3 + H2O = HCl+5O3 + HCl+7O4.
2. Взаємодія з лугами з утворенням солей:
СO2 + Ca(OH)2 = Ca(HCO3)2; SO3 + 2NaOH = Na2SO4 + H2O.
Кислотні оксиди, утворені елементами, що перебувають у проміжному ступені окиснення у цьому випадку утворюють дві солі:
2N+4O2 + 2NaOH = NaN+3O2 + NaN+5O3 + H2O.
3. Взаємодія з основними та амфотерними оксидами з утворенням солей:
P2O5 + 3Na2O + = 2Na3PO4; SO3 + ZnO = ZnSO4.
4. Взаємодія з амфотерними гідроксидами з утворенням солей та води:
3N2O5 + 2Al(OН)3 = 2Al(NO3)3 + 3Н2О.
5. Взаємодія у розчинах із середніми солями відповідних кислот з утворенням кислих солей (якщо це можливо):
СO2 + СаСО3 + Н2О = Са(НСO3)2.
6. Участь в окисно-відновних реакціях:
С+4О2 + С0 = 2С+2О; 4Cr+6O3 + C–42H5OH = 2Cr+32O3 + 2C+4O2 + 3H2O;
S+4O2 + 2H2S–2 = 3S0 + 2H2O; Mn+4O2 + 4HCl–1 = Mn+2Cl2 + Cl02 + 2H2O.
Амфотерні оксиди – залежно від умов виявляють властивості основних або кислотних оксидів. Їх утворюють лише метали побічних підгруп, які перебувають у проміжних ступенях окиснення, а також берилій Be та алюміній Al. В амфотерних оксидах реалізується іонно-ковалентний хімічний зв’язок, за н.у. – усі вони тверді речовини.
Хімічні властивості амфотерних оксидів
- З водою не реагують, амфотерні гідроксиди одержують іншими методами (див. Амфотерні гідроксиди).
- Аналогічно з основними, реагують з кислотами та кислотними оксидами, утворюючи солі:
Al2O3 + 6HCl = 2AlCl3 + 3H2O; Cr2O3 + 3SO3 = Cr2(SO4)3.
- Аналогічно з кислотними, реагують у розплаві з основами та основними оксидами, утворюючи солі:
ZnO + 2KOH = K2ZnO2 + H2O; Al2O3 + Na2O = 2Na2AlO2.
Воду теж можна розглядати як амфотерний оксид, оскільки вона при дисоціації утворює іони Н+ і ОН–:
Н2О ↔ Н+ + ОН–, або Н2О + Н2О ↔ Н3О+ + ОН–,
і реагує з кислотними та основними оксидами з утворенням кислот або основ відповідно.
Застосування оксидів розглянуто при вивченні хімії елементів.