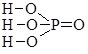13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13.5. Кислоти
Кислоти – сполуки, в яких атоми Гідрогену, що входять до їх складу можуть заміщуватись атомами металів з утворенням солей:
2HCl + 2Na = 2NaCl + H2, H2SO4 + Fe = FeSO4 + H2.
Сучасне визначення кислот див. Електролітична дисоціація.
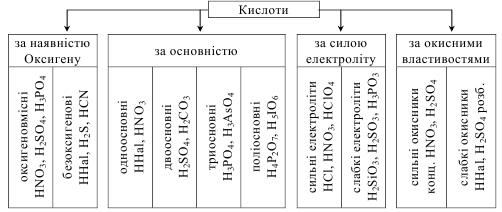
Кислоти класифікують за різними критеріями (схема 13.2).
Схема 13.2
Класифікація неорганічних кислот
Поширені два типи номенклатури кислот – хімічна (систематична або раціональна) і тривіальна. Перша найчастіше застосовується у науковій літературі, друга – у промисловості, побуті. Чіткого розподілу сфер їх використання немає.
Згідно сучасної української хімічної номенклатури систематичні назви кислот складаються з двох слів, друге з яких кислота. Корінь першого слова походить від назви елемента, що утворює кислоту, з додаванням суфікса -ат- (нітратна кислота HNO3 – сполука Нітрогену N, карбонатна кислота H2CO3 – сполука Карбону C тощо). У випадку оксигеновмісної кислоти це слово може включати показник ступеня окиснення елемента. Якщо елемент, який утворює кислоту, перебуває у максимальному ступені окиснення, то його зазвичай не вказують (H2S+6O4 – сульфатна кислота), в іншому випадку ступінь окиснення вказують у дужках (H2S+4O3 – сульфатна (IV) кислота).
Перше слово назви безоксигенової кислоти походить від назви елемента з додаванням суфікса -ід- або -ид- (сульфідна кислота Н2S, йодидна кислота НІ).
Для деяких найважливіших кислот поряд із систематичними назвами збереглися раціональні. У цих назвах різні ступені окиснення елементів, що утворюють кислоти позначаються префіксами і/або суфіксами: Н3Р+3О3 –фосфатсита, Н3Р+5О4 – ортофосфатна, H2S+4O3 – сульфітна, H2S+6O4 – сульфатна, HCl+1O – гіпохлоритна, HCl+3O2 – хлоритна, HCl+5O3 –хлоратна, HCl+7O4 – перхлоратна кислоти.
Раціональні назви аніонів походять від хімічних назв відповідних кислот (табл. 13.7). Номенклатуру органічних кислот детально розглянуто у розд. Органічна хімія.
Таблиця 13.7
Назви деяких кислот та їх аніонів
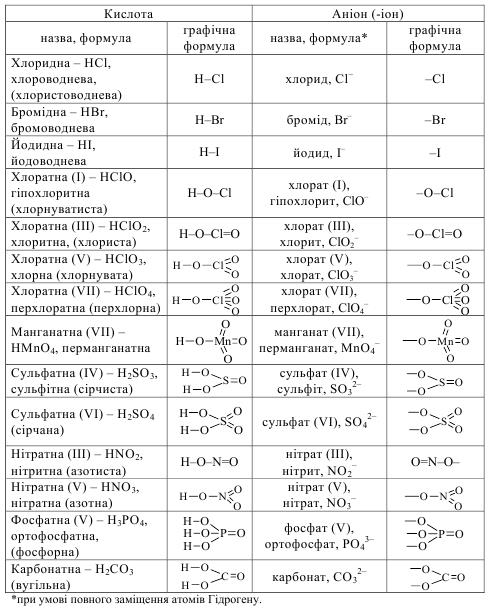
Графічні формули.
В оксигеновмісних кислотах атоми Гідрогену зв’язані з атомом елемента-кислотоутворювача через атоми Оксигену (табл. 13.7).
В оксигеновмісних кислотах, молекули яких містять 2 або більше атомів елемента-кислотоутворювача, ці атоми з’єднані через атоми Оксигену:
Н4Р2О7: 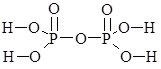 ; H2Cr2O7:
; H2Cr2O7: 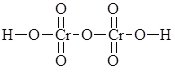
Слід запам’ятати, що не завжди кількість атомів Гідрогену збігається з основністю кислоти, оскільки основність визначають лише атоми Гідрогену, зв’язані з центральним атомом через Оксиген (табл. 13.8).
Таблиця 13.8
Основність деяких оксигеновмісних кислот фосфору
|
Назва |
Формула |
Графічна формула |
Основність |
|
Метафосфатна |
НРО3 |
|
1 |
|
Гіпофосфітна |
Н3PO2 |
|
1 |
|
Фосфітна |
Н3PO3 |
|
2 |
|
Ортофосфатна |
Н3PO4 |
|
3 |
Ще очевидніше це виявляється у молекулах вищих карбонових кислот, які містять велику кількість атомів Гідрогену, залишаючись при цьому одноосновними: С17Н33СООН – олеїнова, С17Н35СООН – стеаринова кислоти.
Одержання кислот.
- Безоксигенові кислоти одержують безпосередньо взаємодією неметалу з воднем:
Н2 + Hal2 = 2HHal, Н2 + S = H2S.
2. Оксигеновмісні кислоти утворюються при взаємодії кислотних оксидів (ангідридів) з водою:
Р2О5 + Н2О = Н3РО4, SO3 + H2O = H2SO4,
СlO2 + H2O = HClO + HClO2
3. Кислоти, ангідриди яких з водою не реагують, добувають з їх солей реакціями обміну:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3.
Таким чином можна одержати й деякі інші кислоти, за умови, що у реакції утворяться газоподібні, малорозчинні або малодисоційовані сполуки:
NaCl(тв.) + H2SO4(к.) = HCl + NaHSO4,
FeS + 2HCl = FeCl2 + H2S.
- Безоксигенові та оксигеновмісні кислоти можна одержати гідролізом відповідних галоген- або тіоангідридів:
PCl5 + 4H2O = H3PO4 + 5HCl, POCl3 + 3H2O = H3PO4 + 3HCl,
PBr3 + 3H2O = H3PO3 + 3HBr, SO2Cl2 + 2H2O = H2SO4 + 2HCl,
P2S3 + 6H2O = 2H3PO3 + 3H2S, P2S5 + 8H2O = 2H3PO4 + 5H2S,
2.Деякі кислоти можна одержати шляхом окисно-відновних реакцій:
Сl2 + H2O(гаряча) = HCl + HClO3, Сl2 + H2O(холодна) = HCl + HClO,
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO, S + 2HNO3 = H2SO4 + 2NO.
Фізичні властивості кислот.
За н. у. кислоти перебувають у твердому (силікатна H2SiO3, боратна H3BO3, ортофосфатна H3PO4) або рідкому (сульфатна H2SO4, нітратна HNO3) стані. Вони добре розчинні у воді (крім H2SiO3). Водні розчини газоподібних сполук гідрогену з деякими неметалами (HHal, H2S, HCN) теж є кислотами.
Розчини кислот кислі на смак, роз’їдають тканини, шкіру. Усі кислоти змінюють забарвлення індикаторів (див. Індикатори).
Хімічні властивості кислот умовно можна розділити на дві групи:
І. Спільні для всіх кислот, пов’язані з наявністю у їх розчинах іонів гідроксонію Н3О+.
ІІ. Специфічні, характерні для конкретних кислот (зокрема якісні реакції), розглянуті при вивченні відповідних елементів.
Розглянемо спільні властивості кислот.
Іон Н+, який обов’язково наявний у водних розчинах усіх кислот у формі Н3О+, з одного боку може вступати в окисно-відновні реакції, відновлюючись при цьому до молекулярного водню Н2, а з іншого – взаємодіяти з негативно зарядженими або нейтральними частинками, які мають неподілені електронні пари (кислотно-основна взаємодія).
Окисно-відновні реакції – взаємодія кислот з металами, які в ряду стандартних електродних потенціалів розміщені до Гідрогену:
2Ме + 2nН+ = 2Меn+ + nH2.
За цією схемою реагують усі кислоти-неокисники.
Кислотно-основними є реакції з основними оксидами, основами (див. вище), середніми, основними та іноді з кислими солями (див. Солі) з утворенням нових солей:
H2SO4 + СаO = CaSO4↓ + H2O, HCl + NaOH= NaCl + H2O,
2HNO3 + BаCO3 = Ba(NO3)2 + CO2↑ + H2O,
4HBr + (CuOH)2CO3 = 2CuBr2 + CO2↑ + 3H2O,
H2SO4 + 2KHSO3 = K2SO4 + 2SO2↑ + 2H2O.
Багатоосновні кислоти, перебуваючи у реакційній суміші у надлишку, реагують із середніми солями утворюючи кислі солі:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2, KOH + H2SO4 = KHSO4 + H2O,
Окремим випадком кислотно-основної взаємодії є кольорові реакції з індикаторами (див. Індикатори).
При нагріванні оксигеновмісні кислоти відщеплюють воду з утворенням ангідридів:
2H3PO4 = P2O5 + 3H2O, 4HNO3 = 4NO2 + 2H2O + O2.