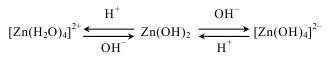13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13.6. Амфотерні гідроксиди
Поряд з типовими основами та кислотами існує велика група гідроксидів, які можуть взаємодіяти з кислотами (виявляючи при цьому властивості основ) або з основами (виявляючи кислотні властивості) з утворенням солі та води – амфотерні гідроксиди.
До них належать гідроксиди металів головних підгруп (берилію Ве, алюмінію Al) і багатьох металів побічних підгруп Періодичної системи, які перебувають у проміжних ступенях окиснення: Ве(ОН)2, Al(OH)3, Zn(OH)2, Cr(OH)3, Pb(OH)2 тощо.
Розглянемо амфотерність на прикладі цинк гідроксиду Zn(OH)2.
У водному розчині Zn(OH)2 дисоціює за схемою:
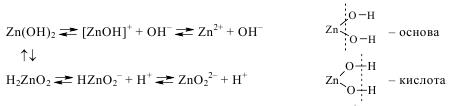
За рахунок однакової кількості утворених іонів Н+ та ОН– амфотерні гідроксиди не змінюють колі індикаторів.
Одержують амфотерні гідроксиди тими ж способами, що й нерозчинні у воді основи – взаємодією солей з лугами:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4.
Для запобігання розчинення утвореного амфотерного гідроксиду у надлишку лугу:
NaOH + Al(OH)3 = Na[Al(OH)4],
останнього беруть менше від розрахованої кількості.
Хімічні властивості амфотерних гідроксидів.
- Кислотні властивості виявляються у реакціях з водними розчинами лугів:
H2ZnO2 + 2NaOH = Na2[Zn(OH)4],
або при сплавленні у твердому стані:
H2ZnO2 + 2NaOH = Na2ZnO2 + 2Н2О.
- Основні властивості виявляються у реакціях з кислотами:
Zn(OH)2 + HСl = ZnCl2 + 2 Н2О.
Схематично запишемо перетворення Zn(OH)2 у водних розчинах, залежно від рН середовища: