17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17.3. Вода
Вода – найпоширеніша хімічна сполука. Це гідроген оксид – Н2О.
Будова молекули.
У молекулі води атоми Гідрогену та Оксигену з’єднані ковалентним полярним зв’язком. Валентний кут » 104,50С, що свідчить про sp3-гібридизацію атомних орбіталей Оксигену і утворення міцних зв’язків з атомами Гідрогену.
Таким чином молекула води – кутова полярна (рис. 17.1). На атомі Оксигену виникає частковий негативний заряд, на атомах Гідрогену – позитивний.
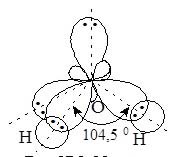
Рис. 17.1. Молекула води
У воді розчиняється багато речовин, при цьому деякі з них дисоціюють на іони. Виходячи з будови молекули – вода сильно полярний розчинник. Є розчинники полярніші за воду: HF, H2SO4, H2O2, HCN, N,N-диметилформамід (ДМФА) (CH3)2NCOH, ацетон CH3COCH3. Усі вони крім двох останніх є високореакційноздотними і тому їх широко не використовують. Вода за фізико-хімічними властивостями є унікальним розчинником.
У твердому стані (лід) вода має тетраедричну структуру – кожна молекула води з’єднана водневими зв’язками з чотирма іншими (рис. 17.2).
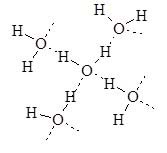
Рис. 17.2. Структура льоду.
Оксид дейтерію D2O (важка вода) міститься у незначній кількості у природній воді. Виділяють D2O виморожуванням води (т. пл. D2O 3,81 0С, т. кип. 101,43 0С). Густина важкої води вища від густини звичайної.
Фізичні властивості.
За н. у. вода – безбарвна рідина без смаку і запаху. Т. пл. води 0 0С або 273 К, Т. кип. 100 0С або 373 К. Густина льоду 0,916 г/см3, густина води при 0 0С 0,999 г/см3, при 4 0С 1,000 г/см3. За рахунок цього, водойми взимку не промерзають до дна.
У ряду гідридів елементів VIA групи H2O – H2S – H2Se – H2Te, вода має аномально високі температури кипіння і плавлення за рахунок утворення водневих зв’язків (див. Водневий зв’язок) і є добрим розчинником.
У воді розчиняються гази, які вступають у хімічну взаємодію з нею (амоніак NH3, ангідриди кислот) (див. Розчини), електроліти (солі, кислоти, луги), органічні сполуки з полярними групами (-OH, -COOH, -NH2).
Поширення у природі.
Поверхня Землі на 4/5 вкрита шаром води; маса води становить 1018 т. Це єдина речовина, яка в природі існує одночасно в твердому (лід), рідкому і газоподібному (пара) стані. 2/3 людського тіла складає вода, багато продуктів містять велику кількість води (табл. 17.2).
Таблиця 17.2
Вміст води у деяких продуктах
|
Продукт |
Вміст води, % |
|
Томати |
95 |
|
Молоко |
87 |
|
Яблука |
84 |
|
Риба |
82 |
|
Картопля |
76 |
|
Яйця |
75 |
|
М’ясо (яловичина) |
64 |
Хімічні властивості.
1. Електролітична дисоціація:
Н2О + Н2О ↔ Н3О+ + ОН–
Н2О – амфоліт, оскільки при дисоціації утворює іони Н3О і ОН– (див. Електролітична дисоціація).
2. Гідратація – приєднання молекул води до речовин з утворенням гідратів. Гідрати утворюють практично усі речовини. Благородні гази (крім гелію) утворюють кріогідрати складу Е∙6Н2О, які називають сполуками вкорінення або клатратами.
Гідрати основних оксидів – основи (NaOH, Ca(OH)2).
Гідрати кислотних оксидів – кислоти (HNO3, H2SO4, H3PO4).
Усі іони в розчинах існують у гідратованому стані: Н+ у формі H3O+, Cu2+ – [Cu(H2O)5]2+ тощо.
При випаровуванні розчинів солей утворюються тверді кристалогідрати: FeSO4∙7H2O, CuSO4∙5H2O, Na2SO4∙10H2O, тощо (див. Кристалогідрати).
Взаємодією органічних речовин з водою добувають спирти, кетони:
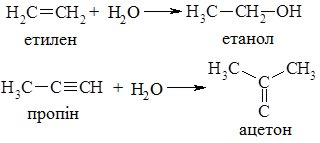
3. Гідроліз – реакція обмінного розкладу речовини з водою. Гідролізу піддаються галогени (крім F2, який розкладає воду):
Cl2 + H2O = HCl + HClO,
8F2+ 14H2O = 14HF + H2O2 + O2 + O3 + OF2,
галогенангідриди (див. Добування кислот):
PCl3+ 3H2O = 3HCl + H3PO4,
солі (див. Гідроліз солей).
Гідроліз органічних сполук розглянуто у розд. Органічна хімія.
4. Взаємодія з металами. Безпосередньо вода реагує лише з металами ІА та ІІА підгруп:
2Na + 2H2O = 2NaOH + H2,
за високих температур – з рештою (крім благородних):
3Fe + 4H2O = Fe3O4 + 4H2,
5. З неметалами за високих температур:
C + H2O = CO + H2,
2P + 8H2O = 2H3PO4 + 5H2.
6. Зі складними речовинами:
NaH + H2O = NaOH + H2, 2BaO2 + 2H2O =2Ba(OH)2 + O2,
CO + H2O = CO2 + H2, CH4 + H2O = CO + 3H2
Останню реакцію – конверсію метану – використовують у промисловості для одержання водяного газу (суміші СО + Н2).
Використання води.
Велика кількість води використовується у побуті: життєдіяльність людини, приготування їжі, прання, тощо.
У промисловості воду використовують як розчинник, реагент, охолоджувач, теплоносій в електростанціях, при виробництві ліків.
Щорічно у світі використовується на різні потреби 2500 – 3000 км3 прісної води.
Забруднення та очистка води.
З усієї маси води на Землі, прісної лише 3%, з них 80% знаходиться на полюсах у формі льоду.
Використання прісної води є багаторазове і безповоротне. Судноплавство, риборозведення, гідроелектроенергетика – багаторазове. Безповоротно використаною є вода, непридатна для повторного використання. Сюди входить вода, яка випарувалась, хімічно зв’язана і змішана з солоною. Прісну воду добувають із солоної шляхом опріснення останньої. Найчастіше вода забруднена твердими відходами, хімічними речовинами (мінеральні добрива, пестициди), мікроорганізмами, радіоактивними речовинами.
Для повернення забрудненої води у використання її очищають фізичними та хімічними методами.
Основними фізичними методами очистки води є:
зрешечування – видалення з води твердих матеріалів шляхом пропускання через систему сит з різним діаметром отворів;
аерування – пропускання через воду повітря для видалення розчинених газів і очищення від деяких домішок;
флокуляція – збовтування води з флокулянтами (H2SiO3) для укрупнення дрібних завислих частинок у більші, які швидше осідають на дно;
флотація – спливання на поверхню частинок, утворених при флокуляції;
седиментація – видалення осілих при флокуляції частинок;
фільтрування – пропускання води через пісок, змішаний з деревним вугіллям для видалення дрібного завислого матеріалу.
Найпоширенішими хімічними методами очистки води є:
коагуляція – видалення з води колоїдних частинок введенням коагулянтів (Al2(SO4)3, Na3[Al(OH)6]);
дезинфекція – обробка води хлором або озоном для знищення мікроорганізмів;
пом’якшення – усунення твердості води, зумовленої наявністю гідрогенкарбонатів кальцію та магнію Ca(HCO3)2 і Mg(HCO3)2, додаванням Ca(OH)2 або Na2CO3;
адсорбція – поглинання органічних сполук з води активованим вугіллям;
окиснення – переведення токсичних речовин в нешкідливі шляхом окисненням озоном: NaCN + O3 = NaCNО + O2.
Дистиляція – випаровування і конденсація води в дистиляторах. При цьому утворюється обезсолена вода. Цим способом опріснюють морську воду.
Очистка стічних вод має поєднуватись із економним використанням води, впровадженням технологій багаторазового застосування та зменшенням забруднення води.
В основі безвідходних виробництв лежить багаторазове використання води в замкнутому циклі з очисними спорудами.
Кругообіг води в природі.
Щорічно в кругообіг води у результаті випаровування і випадання у формі дощу і снігу задіяно понад 500000 км3 води (рис. 17.3). За теоретичними підрахунками максимальна кількість прісної води, доступної для використання становить майже 40000 км3 за рік.
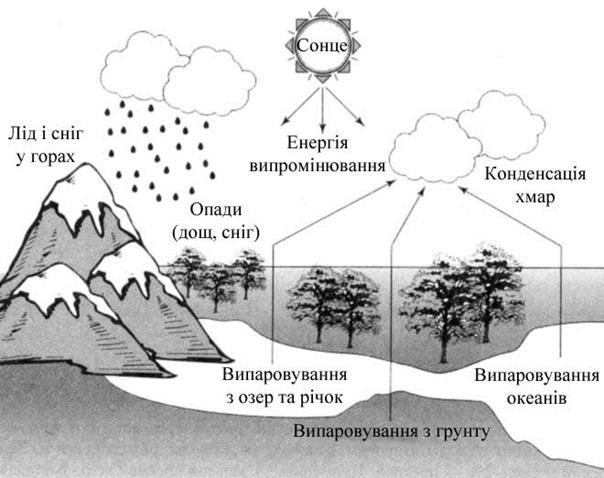
Рис. 17.3. Кругообіг води в природі