25 - 27. Природа органічних сполук
Теорія хімічної будови органічних сполук O. Бутлерова
Теорія хімічної будови органічних сполук O. Бутлерова
Науковою основою органічної хімії є теорія хімічної будови, яку створив російський вчений О. Бутлеров. У 1858–1861 рр. він сформулював основні положення цієї теорії.
1. Атоми розташовані в молекулах не безладно, а сполучені один з одним хімічними зв’язками у певній послідовності, відповідно до їх валентності.
2. Властивості речовин залежать не тільки від їх якісного та кількісного складу, але й від хімічної будови молекул.
3. Атоми або групи атомів у молекулах взаємно впливають один на одного, безпосередньо або через інші атоми.
Розглянемо докладніше положення теорії хімічної будови O. Бутлерова.
Перше положення. До О. Бутлерова вчені вважали, що склад однієї сполуки можна виражати різними формулами, а будову речовин неможливо пізнати. Так, А. Кекуле користувався 20 формулами оцтової кислоти. Більшість вчених взагалі не вірила в існування атомів і молекул.
О. Бутлеров вважав, що атоми та молекули реально існують. Він узагальнив відомі на той час наукові факти та поняття: відкриття валентності елементів (Е. Франкланд, 1858), встановлення чотиривалентності вуглецю (А. Кекуле, 1857), відкриття здатності атомів вуглецю сполучатися один з одним (А. Купер, А. Кекуле, 1857), пропозицію позначати хімічні сили зчеплення атомів валентним штрихом (А. Купер, 1858), уточнення понять «атом», «молекула» (Перший міжнародний конгрес хіміків, 1860).
О. Бутлеров ввів поняття «хімічна будова речовин». Хімічною будовою він назвав послідовність зв’язків атомів у молекулі
Вуглець у органічних сполуках є чотиривалентним. Атоми вуглецю можуть сполучатися у ланцюги різних конфігурацій:
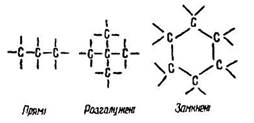
О. Бутлеров стверджував, що кожна органічна речовина має певну хімічну будову, що виражається лише однією структурною формулою, яку можна записати у розгорнутому або скороченому вигляді. Наприклад, порядок сполучення атомів у молекулах етану С2Н6, етилену С2Н4 і ацетилену С2Н2 зображують так:
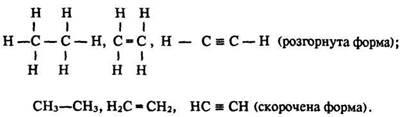
Структурні формули відображають тільки послідовність сполучення атомів, а не їх розміщення в просторі. Тому формули бутану:
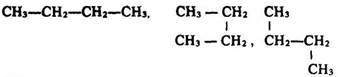
є однією структурною формулою, оскільки порядок сполучення атомів вуглецю в них однаковий.
За структурною формулою речовини можна встановити її властивості. Хімічну будову сполуки визначають шляхом вивчення її хімічних властивостей та реакцій утворення.
Друге положення. Довгий час вчені не могли пояснити явище ізомерії. О. Бутлеров встановив, що ізомери виявляють різні властивості (фізичні та хімічні), тому що мають різну будову. Дійсно, такі ізомери, як диметиловий ефір і етиловий спирт, мають однаковий склад, але різні властивості внаслідок різної хімічної будови. Хімічна будова цих речовин виражається різними структурними формулами.
O. Бутлеров передбачав існування двох ізомерів бутану С4Н10, трьох – пентану С5Н12, а також ізомерів різних спиртів. У 1864 р. він синтезував третинний бутанол:
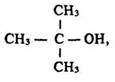
а в 1866 р. – ізобутан:
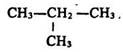
Теорія хімічної будови пояснила причину різноманітності сполук вуглецю. Цією причиною є існування ізомерії, а також здатність чотиривалентного вуглецю утворювати ланцюги, які можуть замикатися в кільця.
Третє положення. З неорганічної хімії відомо, що водень у воді Н2O, хлороводневій кислоті НСl та аміаку NН3 має різні властивості. З хлороводневої кислоти його легко можуть витіснити різні метали, з води – лише лужні та лужноземельні, а з аміаку водень витіснити дуже важко. Це явище обумовлене різним впливом на водень атомів кисню, хлору, азоту.
О. Бутлеров вважав, що під час утворення молекул атоми взаємодіють, надаючи один одному частину своєї хімічної
спорідненості. У молекулах створюється певний порядок розміщення хімічної спорідненості. Тому властивості одного й того ж елемента в різних сполуках різні і відмінні від властивостей ізольованого атома. Положення про взаємний вплив атомів є найважливішим у теорії хімічної будови.
Таким чином, під поняттям «хімічна будова» О. Бутлеров розумів не лише певний порядок сполучення атомів у молекулі, але й порядок їх взаємного впливу. Вчений ще не знав, як відбувається взаємний вплив атомів у молекулі, але розумів, що молекула не є простою сумою атомів, хоча і з’єднаних у певному порядку.
Теорія хімічної будови мала велике значення для наукового розуміння природи, розвитку хімічної науки та промисловості. Її положення стосуються будови органічних і неорганічних речовин.
Сучасна електронна теорія будови речовини підтвердила правильність теорії О. Бутлерова, пояснила природу хімічного зв’язку в органічних сполуках і природу взаємного впливу атомів у молекулах. Атоми в молекулах органічних сполук з’єднані переважно ковалентними простими сигма-зв’язками або кратними сигма та пі-зв’язками (п. 6.1). Чотиривалентність вуглецю визначається електронною будовою його атомів.
Властивості речовин залежать не тільки від їх складу, але й від природи хімічного зв’язку. Під час утворення хімічних зв’язків змінюється електронна будова атомів. Природа їх взаємного впливу обумовлена поляризацією ковалентних зв’язків внаслідок різних електронегативностей атомів (п. 6.2).