2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
2.1. Атомно-молекулярне вчення
Уявлення про те, що всі речовини складаються з певних маленьких частинок існували ще у сиву давнину і у XVIII ст. вони сприяли виділенню хімії у самостійну науку.
Сучасні формулювання основних положень атомно-молекулярного вчення:
- Усі речовини складаються з атомів, молекул або іонів.
- Усі атоми, молекули або іони, що входять до складу речовини перебувають у безперервному русі.
- Усі речовини поділяються на прості і складні.
Розглянемо їх докладніше.
Найменшою хімічно неподільною частинкою речовини, що зберігає властивості речовини є атом (гр. atomoz – неподільний). Атоми бувають різними. Атоми певного виду мають однакові розміри, однакові властивості і відрізняються від атомів інших видів.
На сьогодні встановлено, що атоми складаються з ядра, яке розміщене в центрі атома та складається з позитивно заряджених (протонів) та нейтральних (нейтронів) частинок. Навколо ядра обертаються негативно заряджені частинки (електрони), і оскільки атоми є електронейтральними, то кількість протонів рівна кількості електронів. Тип (вид) атома визначається зарядом ядра (кількістю протонів).
Сукупність атомів з однаковим зарядом ядра називають хімічним елементом.
На сьогодні відомо понад 100 хімічних елементів, біля 90 з яких зустрічаються в природі, а решта одержані штучно, шляхом ядерних реакцій.
Кожен відомий хімічний елемент має свою назву і позначення (символ).
Перші позначення хімічних елементів були у вигляді малюнків (людей, тварин, астрологічних символів): (рис. 2.1).
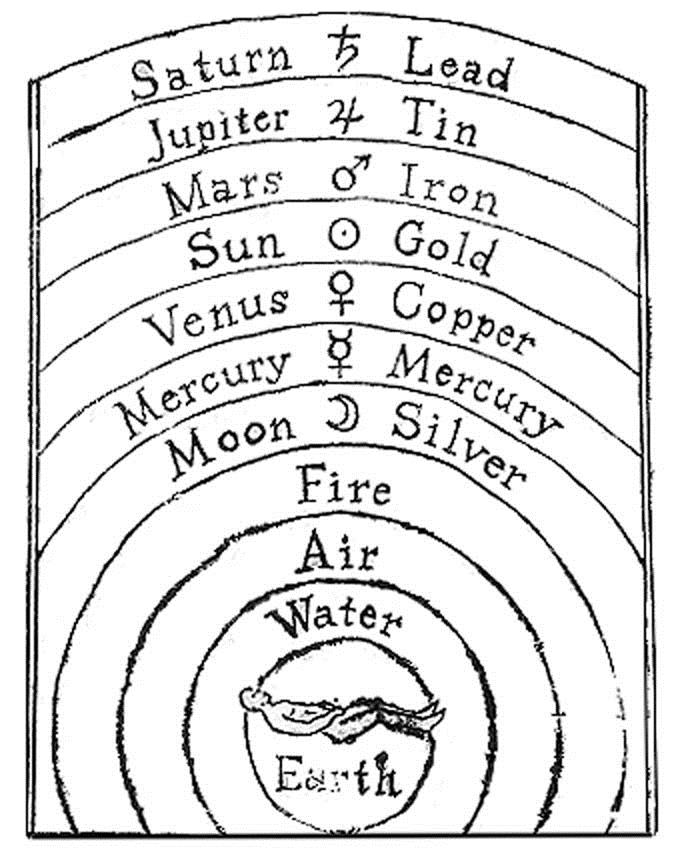
Рис. 2.1. Одна з перших алхімічних “систем хімічних елементів”, у ній символи небесних тіл та відомих на той час елементів однакові (Місяць – Аргентум, Меркурій – Меркурій, Венера – Купрум, Сонце – Аурум, Марс – Ферум, Юпітер – Станум, Сатурн – Плюмбум). До елементів відносили також Землю, Воду, Повітря та Вогонь.
Згодом, коли елементів стало більше, їх стали позначати повними латинськими назвами. Однак, якщо речовина складалась із багатьох елементів, такий запис був дуже громіздким і незручним. Тоді англ. хімік Дж. Дальтон запропонував записувати символи елементів у вигляді різних кружечків:
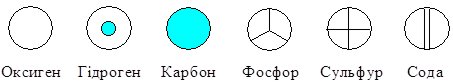
З часом елементів усе більшало і нові кружечки придумувати стало важко. Тоді Дж. Дальтон почав вписувати в кружечки перші літери англійських назв елементів:
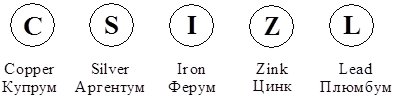
Проте і цей спосіб не набув поширення. Згодом Й. Берцеліус (1779 – 1884) запропонував позначати елемент першою літерою його латинської назви без кружечка. Якщо літера уже була зайнята, додавалась наступна. Так, Карбон (лат. Carboneum) позначають літерою С, а Кальцій і Хлор, відкриті пізніше, – двома літерами – відповідно Са (лат. Calcium) і Cl (лат. Clorum). Ця система позначень збереглася до сьогодні і символи хімічних елементів є універсальним для всіх мов.
Кілька однакових або різних атомів шляхом хімічної взаємодії сполучаються у молекулу, властивості якої відмінні від властивостей атомів, що входять до її складу.
Найменшою механічно (але не хімічно!) неподільною частинкою речовини, що зберігає всі її властивості є молекула (лат. moles – невелика маса). Поряд з цим, окремо взята молекула не обумовлює фізичних властивостей речовини, які визначаються сукупністю молекул.
Атоми у молекулі розміщені у певному порядку за допомогою хімічних зв’язків.
Речовини, що складаються з одного виду атомів (мідь – Сu, водень – Н2) називають простими.
Не слід плутати поняття “хімічний елемент” і “проста речовина”. Прості речовини можуть містити різну кількість атомів одного хімічного елемента і мати їх різне просторове розміщення. Це явище називається алотропією, а речовини – алотропними модифікаціями. Так, хімічний елемент Оксиген (О) утворює дві алотропні модифікації – кисень (О2) та озон (О3), які є простими речовинами з різними фізичними і хімічними властивостями.
Назви простих речовин, виробів з них – традиційні. Золота обручка, кисневий балон, вуглецевий ланцюг, водневий зв’язок, мідні труби тощо.
Якщо речовина складається з молекул, утворених атомами різних хімічних елементів, то її називають складною.
Складних речовин існує набагато більше, ніж простих речовин, тому що атоми різних елементів можуть сполучатись між собою у різних співвідношеннях і послідовності. Наприклад, елемент Гідроген (Н) та Оксиген (О) утворюють воду (Н2О) і гідроген пероксид (Н2О2); елементи Нітроген (N) та Оксиген (О) утворюють сполуки складу N2О, NО, N2О3, NО2, N2О4, N2О5. Ще більше таких прикладів існує в органічній хімії, де з Карбону, Гідрогену, Оксигену та ще кількох хімічних елементів утворено понад 10 млн. речовин.
Склад молекули будь-якої речовини можна виразити за допомогою хімічної формули, у якій вказується види атомів, що входять до її складу, та їх кількість. Так, наведені вище приклади сполук Гідрогену з Оксигеном та Нітрогену з Оксигеном записані з використанням хімічних формул.