5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
5. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
5.3. Структура Періодичної системи хімічних елементів
Першим варіантом Періодичної системи, який запропонував Д.І. Менделєєв, був довгоперіодний варіант, у якому періоди були розміщені в одну лінію. Пізніше він опублікував короткоперіодну форму, де періоди ділились на ряди, а групи на підгрупи.
Зараз найчастіше використовують напівдовгий варіант Періодичної системи, який є, по-суті, короткоперіодним варіантом, у якому для зручності лантаноїди та актиноїди винесені окремо. Надалі будемо користуватись саме таким варіантом Періодичної системи.
У сучасній Періодичній системі міститься 110 хімічний елементів, кожен з яких займає певне місце, згідно порядкового номера (заряду ядра). Для кожного елемента зазначено його символ, назву, порядковий номер та середню відносну атомну масу або масу найстабільнішого ізотопу.
Періодична система складається з семи горизонтальних періодів, перші три з яких (1 – 3) містять по одному ряду елементів і тому є малими. Решта періодів (4 – 7) є великими, вони містять по два ряди елементів.
Кожен період починається лужним металом і закінчується благородним газом. Лише перший період починається з неметалу, а сьомий – ще не завершений.
Елементи перших трьох періодів називають типовими, їх властивості плавно змінюються від типового металу до благородного газу.
У великих періодах властивості елементів плавно змінюються лише у непарних рядах (5, 7 і 9). У парних рядах (4, 6, 8, 10) розміщені метали і періодичність зміни їх властивостей малопомітна.
Лантаноїди розміщені окремим рядом внизу таблиці. Їх властивості яких схожі з Лантаном, у довгоперіодному варіанті Періодичної системи вони розміщені відразу після нього і є елементами 6 періоду.
Аналогічно розташовані і актиноїди – елементи 7 періоду, з властивостями, аналогічними Актинію.
У 1 періоді міститься 2 елементи, у 2 – 8, 3 – 8, 4 – 18, 4 – 18, 6 – 32, 7 – 21 (незавершений період).
По вертикалі у Періодичній системі розміщено вісім груп, які позначають римськими цифрами І – VIІІ. В межах кожної групи виділяють головну (або А) і побічну (або В) підгрупу.
Номер групи, як правило, рівний максимальному позитивному ступеню окиснення елемента. Винятками є Флуор (елемент VIІА групи, ступінь окиснення – 1), Купрум (ІА, +2), Аргентум (ІА, +1), Аурум (І А, +3); серед елементів VIІІ В групи, ступінь окиснення +8 характерний лише для Осмію, Рутенію та Ксенону.
Елементи головної та побічної підгруп у межах групи розташовані по різні сторони вертикального ряду (головної – зліва, побічної – справа). На рис. 5.1 це показано на прикладі VIІ групи.
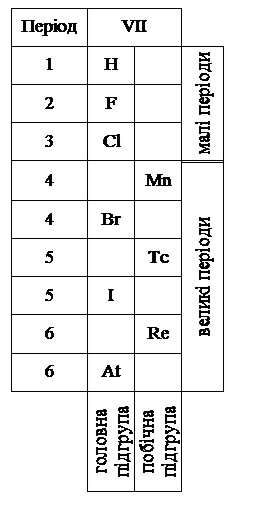
Рис. 5.1. Структура VII групи.
У головних підгрупах розміщені типові елементи (2 і 3 періодів) і схожі за властивостями елементи великих періодів.
У побічних підгрупах розташовані елементи-метали великих періодів.
Властивості елементів головної та побічної підгрупи в межах однієї групи дуже відмінні. Так, у VIІА підгрупі розміщені неметали – галогени (F, Cl, Br, I, At), а у VIІВ підгрупі – метали (Mn, Tc, Re).
У ІІІВ підгрупі розміщені елементи 6 періоду (лантаноїди) та 7 періоду (актиноїди).
VIIВ підгрупа містить три побічні підгрупи (підгрупи Феруму, Кобальту та Ніколу).
Часто зустрічаються історичні назви окремих груп і підгруп Періодичної системи: ІА підгрупа – лужні метали, ІІА – лужноземельні метали, ІІІВ (лантаноїди та актиноїди) – рідкісноземельні метали, VА – пніктогени, VIА – халькогени, VIІА – галогени, VIІІА – благородні гази.
Характеризувати положення елемента у Періодичній системі слід за такою схемою (для прикладу поряд наведено характеристику Мангану):
|
Період – Ряд – Група – Підгрупа – Порядковий номер (заряд ядра) – |
4 4 VII В 25 |