6. ХІМІЧНИЙ ЗВ’ЯЗОК
6. ХІМІЧНИЙ ЗВ’ЯЗОК
6.3. Гібридизація атомних орбіталей та геометрія молекул
Орбіталі деяких атомів у процесі утворення хімічного зв’язку змінюють свою форму, енергію та просторову орієнтацію, внаслідок чого збільшується область перекривання електронних хмар і зв’язок стає міцнішим.
Незважаючи на те, що в утворенні хімічного зв’язку беруть участь орбіталі різної форми та просторової орієнтації (s-, p-, d- та f-орбіталі), у сполуках ці орбіталі є рівноцінними.
Для пояснення цього явища американський вчений Л. Полінг у 1931 р. ввів поняття “гібридизація” – вирівнювання різних атомних орбіталей за формою та енергією при утворенні хімічного зв’язку.
Гібридизація може бурти кількох видів. Розглянемо кожен з них на прикладі молекул BeCl2, BF3 та NH3.
В основному (незбудженому) стані конфігурація зовнішнього електронного рівня атома Берилію записується 2s22р0. Перехід атома у збуджений стан веде до розпарування 2s2-електронів і переходу одного з них на 2р-підрівень:
+4Be 1s22s22p0 → +4Be 1s22s22p0
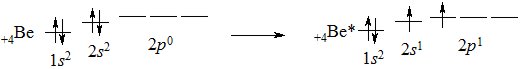
У збудженому стані атом Берилію може приєднати два атоми Хлору, у яких на зовнішньому електронному рівні знаходиться по 1 неспареному електрону. Енергія, що виділяється при утворенні двох s-зв’язків, компенсує енерговитрати на переведення атома Берилію у збуджений стан (перехід електрона з 2s- на 2р-підрівень). Обидва зв’язки Be – Cl однаково міцні і розміщені в просторі під кутом 180 0. Це пояснюється тим, що різні за формою та енергією s- та р-орбіталі атома Берилію гібридизувались – вирівнялись за формою та енергією і набули максимально віддаленого у просторі розміщення периферійних областей.
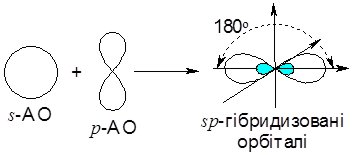
Рис. 6.6. Схемa гібридизації s- та р-орбіталей атома Берилію.
Зазначимо, що кількість гібридизованих орбіталей завжди рівна кількості вихідних (негібридизованих) орбіталей.
Якщо у процесі гібридизації беруть участь одна s- та одна р-орбіталі центрального атома (як розглянутому нами випадку), цей тип гібридизації називається sр-гібридизацією, а утворені орбіталі – sр-гібридизованими. Такі орбіталі завжди розташовані у просторі під кутом 180 0, за рахунок чого молекули при цьому мають лінійну форму. Для прикладу на рис. 6.7. зображена молекула BeCl2.
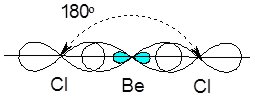
Рис.6.7. Просторове розташування sp-гібридизованих орбіталей у молекулі BeCl2.
В атома Берилію у збудженому стані конфігурація зовнішнього електронного рівня записується 2s12р2 (один 2s-електрон переходить на 2р-орбіталь). Гібридизації зазнає одна s- і дві р-орбіталі, тому у цьому випадку має місце sр2-гібридизація.
Внаслідок цього процесу утворюються три sр2-гібридизовані орбіталі, розташовані у просторі під кутом 120 0:
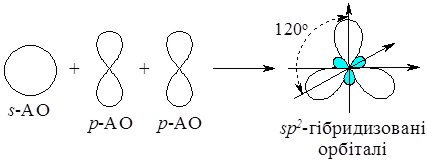
Рис. 6.8. Утворення sр2-гібридизованих орбіталей атома Бору.
Зв’язки в молекулі BF3 утворюються за рахунок одного 2s-, двох 2р-електронів атома Бору та по одному 2р-електрону кожного атома Флуору. В просторі молекула має форму трикутника:
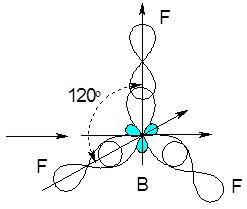
Рис. 6.9. Просторова конфігурація молекули трифториду бору BF3.
При утворенні зв’язків N – H у молекулі NH3 відбувається гібридизація однієї s- і трьох р-орбіталей атома Нітрогену. Утворюються чотири sp3-гібридизовані орбіталі, три з яких утворюють зв’язки з атомами Гідрогену, а четверту займає неподілена електронна пара атома Нітрогену.
Молекула NH3 має форму трикутної піраміди з атомом Нітрогену на вершині:
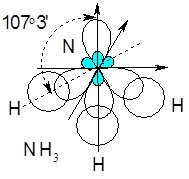
Рис. 6.10. Просторова конфігурації молекули NH3
Валентний кут НNH повинен був становити 109,5 0, однак насправді його значення 107,5 0, що пояснюється впливом неподіленої електронної пари атома Нітрогену. Аналогічне пояснення відхилення валентного кута НОН у молекулі води Н2О (104,5 0) за рахунок відштовхування двох неподілених електронних пар атома Оксигену.
Один атом може утворювати різні гібридизовані стани. Це розглянуто на прикладі атома Карбону в розділі “Органічна хімія”.
Геометрію молекул різного типу наведено в табл. 6.3.
Таблиця 6.3
Просторова конфігурація деяких молекул
|
Тип молекули |
Просторова структура |
Валентний кут, 0 |
Приклади сполук |
|
АВ2 |
кутова |
> 90 |
H2O, H2S |
|
лінійна |
180 |
BeCl2, MgBr2, CO2 |
|
|
AB3 |
пірамідальна |
107,5 |
NH3, PCl3, AsH3 |
|
трикутна |
120 |
BCl3 |
|
|
АВ4 |
тетраедрична |
109,5 |
CH4, CCl4, SiH4 |