7. ХІМІЧНІ РЕАКЦІЇ
7. ХІМІЧНІ РЕАКЦІЇ
7.1. Загальні положення
Перетворення речовин відбувається у ході хімічних реакцій. Для зображення хімічних реакцій користуються хімічними рівняннями, у яких за допомогою хімічних формул і знаків записують реагенти та продукти реакції, а також кількісні співвідношення між ними.
Хімічні рівняння складаються з двох частин, які сполучені знаком “=” “→” або “↔”. Знак рівності ставлять у випадку повністю збалансованого (за елементами та зарядами) рівняння реакції, що відбувається у даному напрямку до кінця. Знак оборотності ставлять для підкреслення оборотності процесу. Стрілку записують у незбалансованих схемах реакцій і в органічній хімії, щоб не сплутати знак “=” з подвійним зв’язком. У лівій частині реакції записують формули реагентів, у правій – продуктів. Кількість атомів кожного елемента до і після реакції повинна бути однаковою, що досягається розставленням коефіцієнтів. Коефіцієнти – цифри, що ставлять перед символами елементів або формулами речовин і вказують на їх кількість.
Хімічні рівняння складають у відповідності із законом збереження маси та енергії.
Основні етапи складання рівнянь хімічних реакцій:
1. Зліва записують формули реагентів, справа – формули продуктів, стрілкою вказують напрям реакції:
Al + HCl → AlCl3 + H2
2. Підраховують кількість атомів кожного елемента до і після реакції, при необхідності розставляють коефіцієнти та заміняють стрілку знаком “=”:
2Al + 6HCl = 2AlCl3 + 3H2
Основні типи хімічних рівнянь:
1. Молекулярні – речовини записують у формі молекул або атомів:
Р2О5 + Н2О = Н3РО4.
2. Іонні – речовини записують у формі іонів:
Н+ + ОН– = Н2О.
3. Електронні та електронно-іонні – вказують ступені окиснення елементів або заряди іонів та кількість електронів, що беруть участь у даному процесі:
Cr2O72– + 14H+ + 6е = 2Cr3+ + 7H2O.
4. Термохімічні – вказують агрегатні стани речовин та тепловий ефект реакції.
С(кр) + O2(г) = СO2(г), ΔН = – 395,3 кДж/моль.
Характерними ознаками проходження хімічних реакцій є:
1. Зміна забарвлення:
2HgO = 2Hg + O2
червоний блискучий безбарвиний
2. Утворення гетерогенних продуктів:
осаду: K2SO4 + BaCl2 = BaSO4↓ + KCl,
або газу: CaCO3 + 2HCl = CaCl2 + CO2↑
3. Виділення або поглинання енергії у вигляді тепла і/або світла:
2Fe + 3O2 = Fe2O3
Існує кілька класифікацій хімічних реакцій залежно від утворених продуктів, агрегатного стану реагентів, оборотності, теплового ефекту, наявності каталізатора, зміни ступеня окиснення елементів, механізму проходження. Остання класифікація широко застосовується в органічній хімії і розглянута у розд. Органічна хімія.
Залежно від результату реакції (утворених продуктів) виділяють основні типи хімічних реакцій:
- Сполучення – з кількох речовин або атомів утворюється нова речовина або молекула: 2Н2 + О2 = 2Н2О.
- Розкладання – з однієї речовини або молекули утворюється кілька нових речовин або атомів: 2HgO = 2Hg + O2.
- Обміну – реагенти обмінюються своїми складовими з утворенням нових речовин: NaCl + AgNO3 = NaNO3 + AgCl.
- Заміщення – один реагент заміщає в іншому певну структурну частину (атом, іон): 2NaBr + Cl2 = 2NaCl + Br2.
За агрегатним станом реагентів виділяють:
- Гомогенні – реагенти перебувають в одному агрегатному стані: 2H2(г) + O2(г) = 2H2O(г).
- Гетерогенні – реагенти перебувають у різних агрегатних станах: С(кр) + O2(г) = СO2(г).
За ознакою оборотності розрізняють реакції:
- Необоротні – відбуваються лише в прямому напрямку і реагенти повністю перетворюються в продукти: Zn + 2HCl = ZnCl2 + H2.
- Оборотні – можуть відбуватись у двох напрямках (прямому і зворотному), не доходячи до кінця по жодному з них: N2 + 3H2 ↔ 2NH3.
За зміною теплового ефекту розрізняють:
- Екзотермічні – теплота виділяється з реакційного середовища.
- Ендотермічні – теплота поглинається з навколишнього середовища.
За наявністю каталізатора розрізняють:
- Каталітичні – відбуваються у присутності каталізатора
- Некаталітичні – проходять без каталізатора.
За зміною ступеня окиснення елементів розрізняють:
- Реакції невалентних перетворень – відбуваються без зміни ступенів окиснення елементів
- Окисно-відновні реакції – проходять зі зміною ступеня окиснення елементів.
Зазначимо, що будь-яка хімічна реакція може одночасно належати до кількох типів. Так, реакція: 2KClO3 = 2KCl + 3O2, що відбувається у присутності MnO2 є гомогенною, необоротною, ендотермічною, каталітичною, окисно-відновною реакцією розкладу.
Кількісні співвідношення між реагентами та продуктами вивчає стехіометрія реакцій.
Розглянемо реакцію:
2HCl + CaCO3 = CaCl2 + CO2 + H2O.
Коефіцієнти у рівнянні реакції вказують молярне співвідношення реагентів та продуктів: 2 моль HCl реагує з 1 моль CaCO3, при цьому утворюється 1 моль CaCl2, 1 моль CO2 і 1 моль H2O (або 73 г HCl реагує зі 100 г CaCO3, утворюючи 111 г CaCl2, 44 г CO2 і 18 г H2O).
Однак, на практиці часто утворюється менша кількість продуктів реакції, ніж розрахована за рівнянням реакції. Причини цього різні – наявність домішок у реагентах, недотримання технології процесу, проходження рівноважних реакції (напр., синтез НІ або NH3 з елементів), людські помилки. Показником ефективності хімічної реакції є процентний вихід продуктів реакції (η – ета), %, який обчислюють за формулою:
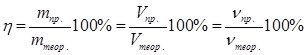 ,
,
де mпр., Vпр., νпр. – відповідно маса, об’єм або кількість моль практично одержаного продукту реакції;
mтеор., Vтеор., νтеор. – теоретично розрахована за рівнянням реакції відповідно маса, об’єм або кількість моль продукту.
Сьогодні фахівці працюють над збільшенням процентного виходу продуктів реакції промислово важливих процесів. Так, застосовуючи сучасні технології добувають амоніак з простих речовин за процесом Габера із виходом понад 90%.