8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
8.1. Швидкість хімічних реакцій
Основним поняттям хімічної кінетики є швидкість реакції.
Відомо, що усі хімічні процеси відбуваються з різною швидкістю. Деякі реакції відбуваються миттєво (фторування органічних сполук молекулярним фтором: СH4 + 2F2 = CF4 + 4HF), для проходження інших іноді необхідно кілька діб (відновлення ароматичних нітросполук до ароматичних амінів сульфідом амонію (NH4)2S у кислому середовищі – реакція Зініна: С6Н5NO2 + (NH4)2S + 2HCl = С6Н5NH2 + 2NH4Cl + SO2).
Швидкість гомогенної реакції, що відбувається в замкненому об’ємі, визначається зміною концентрації реагентів або продуктів за одиницю часу.
Для реакції aA + bB ↔ cC + dD:
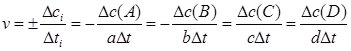
де a, b, c, d – стехіометричні коефіцієнти, Δсі = сі2 – сі1 – зміна концентрації компонента (A, B, C або D) за час Δt = t2 – t1.
Зазначимо, що в ході реакції концентрація реагентів зменшується (сі2 < сі1) і Δсі > 0, а концентрація продуктів – зростає (сі2 > сі1) i Δсі < 0, а оскільки значення швидкості реакції може бути лише більшим від нуля, то для дотримання цієї умови ставиться знак “±”.
Концентрації речовин зазвичай вказують у моль/л, а час – у секундах, тому розмірність швидкості хімічної реакції ![]() або моль×л-1×с-1.
або моль×л-1×с-1.
Швидкість реакції залежить від багатьох факторів, основними з яких є природа реагентів, агрегатний стан, концентрація, температура, наявність каталізатора, тощо.
Вплив природи реагентів виявляється у тому, за однакових умов різні речовини реагують між собою з різною швидкістю. Так, за стандартних умов газоподібні молекулярні водень і фтор, розчини хлороводню і натрій гідроксиду реагують миттєво, а молекулярні водень і бром (або йод) – повільно.
У газовій і рідкій фазах, як правило, реакції відбуваються швидше, ніж у твердій.
Вплив концентрації. Збільшення кількості частинок реагентів в одиниці об’єму збільшує частоту зіткнень між ними, при цьому зростає площа стикання. І хоча не кожне зіткнення веде до утворення продукту, однак ймовірність взаємодії зростає, тому зростає і швидкість реакції.
Для збільшення площі стикання реагенти подрібнюють або переводять у рідку або газову фазу.
Кількісно вплив концентрації на швидкість хімічної реакції описує закон дії мас (К. Гульдберг і П. Вааге, 1867 р., Норвегія).
Швидкість хімічної реакції за даної температури пропорційна добутку концентрацій реагентів або продуктів реакції.
Для реакції aA + bB ↔ cC + dD математично цей закон записується:
v = kСAaСB b = k’СС сСD d,
де СА, СВ, CС i СD – концентрації речовин А, В, С i D відповідно, моль/л, а, b, с і d – стехіометричні коефіцієнти, k i k’ – константи швидкості – коефіцієнти, які не залежать від концентрацій, а залежать від температури і природи реагентів.
Якщо СА = СВ = 1 або СC = СD = 1, то v = k (v = k’), тобто k (k’) – швидкість хімічної реакції при концентрації реагентів (продуктів) 1 моль/л. Це – фізичний зміст константи швидкості.
Описана залежність вірна для реакцій в гомогенному стані.
Коли реакція відбувається в гетерогенній системі, то її швидкість залежить від площі стикання реагентів. У вираз швидкості гетерогенної хімічної реакції не входять значення концентрацій реагентів, що перебувають у твердій фазі, але враховуються концентрації рідких і газоподібних компонентів (іноді для останніх використовують значення парціального тиску). Для реакції
2Mg(тв) + O2(тв) = 2MgO(тв)
вираз швидкості має вигляд v = kСO2 = рO2, де рO2 – парціальний тиск кисню у системі.
Існують реакції, які відбуваються в одну стадію – елементарні реакції, і реакції, що відбуваються у кілька стадій – складні.
У випадку елементарної реакції відбувається один процес і хімічне рівняння описує її справжній механізм.
Для складних багатостадійних реакцій у хімічному рівнянні часто об’єднують кілька стадій і воно показує лише реагенти і продукти, але не відображає реального механізму проходження процесу.
Реакція Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S+ H2O відбувається у дві стадії: Na2S2O3 + H2SO4 = Na2SO4 + Н2SO3 – І стадія
H2SO3 = SO2 + S+ H2O – ІІ стадія.
Для кожної з цих стадій можна визначити швидкість. Стадія, яка відбувається з найменшою швидкістю, визначає загальну швидкість процесу. У наведеному прикладі найповільнішою є ІІ стадія, яку називають лімітуючою.
Вплив температури на швидкість хімічної реакції описується правилом Вант-Гоффа: збільшення температури на кожні 10 0С веде до зростання швидкості реакції у 2 – 4 рази:
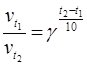 ,
,
де ![]() i
i ![]() – швидкість реакції відповідно за температури t1 i t2, γ – температурний коефіцієнт швидкості реакції (визначається експериментально).
– швидкість реакції відповідно за температури t1 i t2, γ – температурний коефіцієнт швидкості реакції (визначається експериментально).
Точніше вплив температури на швидкість хімічної реакції показав С. Арреніус. Він запропонував теорію активації, згідно з якою у реакцію вступають лише активні молекули. Активні молекули мають визначену для даної реакції енергію, яка перевищує енергію інших молекул. Цей надлишок енергії називають енергією активації.
Між реагентами і продуктами реакції існує проміжний стан, який називають активований комплекс. Особливістю цього стану є те, що старі зв’язки в молекулах реагенту ще не розірвались, а нові ще не повністю сформувались:
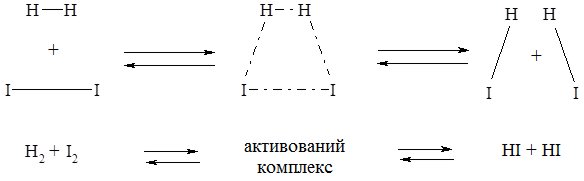
Зв’язки в активованому комплексі слабкіші, ніж у молекулах Н2 та І2, тому хід реакції по такому шляху реакції є енергетично вигідним.
Енергія, що витрачається на активацію молекул повністю або частково компенсується енергією, що виділяється при утворенні продуктів реакції. Коли енергії виділяється більше, то процес є екзотермічним, коли менше – ендотермічним. У розглянутому прикладі енергія активації перевищує тепловий ефект реакції.