8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
8.2. Каталіз і каталізатори
Багато реакцій відбуваються дуже повільно або не відбуваються взагалі у потрібному напрямку без наявності у реакційному середовищі невеликих кількостей певних речовин. Так, у лабораторних умовах для одержання молекулярного кисню використовують реакцію термічного розкладу бертолетової солі (калій хлорату):
2KClO3(тв) = 2KCl(тв) + 3O2(г)
Навіть при значному нагріванні (до початку плавлення) солі, процес відбувається дуже повільно, а основною реакцією є дипропорціювання KClO3:
4KClO3(тв) = 3KClО4(тв) + KCl(тв)
Але якщо перед нагріванням до KClO3 додати невелику кількість манган (IV) оксиду MnO2, швидкість реакції значно зростає, і процес іде у потрібному напрямку з утворенням калій хлориду та молекулярного кисню. Після завершення реакції весь MnO2 залишається кількісно і якісно незміненим.
Речовини, які збільшують швидкість хімічних реакції, беручи участь у проміжних стадіях, але не витрачаються на утворення продуктів реакції називають каталізаторами.
Зміна швидкості реакції під впливом каталізатора називається каталізом, а реакції, що відбуваються за участю каталізаторів – каталітичними.
Якщо реагенти і каталізатор перебувають в одній фазі, каталіз називають гомогенним (прикладом є розглянута реакція розкладу калій хлорату), а коли в різних – гетерогенним (синтез амоніаку NH3 з молекулярних водню та азоту, або окиснення сульфур (IV) оксиду SO2 киснем повітря до сульфур (VІ) оксиду SO3 у присутності V2O5). В останньому випадку швидкість реакції залежить і від площі стикання реагентів, оскільки реакція відбувається на поверхні каталізатора.
Деякі речовини можуть прискорювати одні процеси і сповільнювати інші. Якщо в присутності даної речовини швидкість хімічної реакції зростає, то каталіз позитивний. Якщо швидкість зменшується – негативний. Негативні каталізатори називають інгібіторами. Так, реакція Fe + 2HCl = FeCl2 + H2 не відбувається в присутності уротропіну (гексаметилентетраміну), який є її інгібітором.
Механізм дії каталізаторів пояснюють зниженням енергії активації реакції шляхом утворення проміжних сполук з реагентами (активні комплекси), для чого необхідна менша енергія. Реакція відбувається шляхом, який є енергетично доступнішим:
І. Без каталізатора:
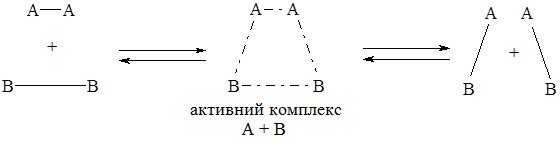
ІІ. З каталізатором:
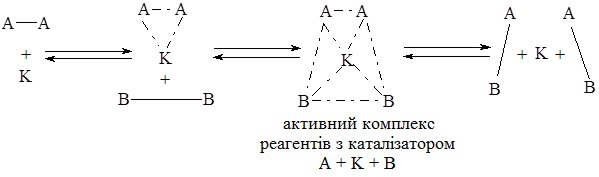
У результаті проходження реакції за ІІ шляхом утворюється продукт АВ а каталізатор К виділяється у незмінному вигляді.
Зі схеми видно, що каталізатор однаково змінює швидкість прямої і зворотної реакції.
Прикладом гомогенного каталізу за таким механізмом є реакції, що лежать в основі виробництва сульфатної кислоти нітрозним методом. Однією із стадій процесу є окиснення сульфур (IV) оксиду SO2 киснем повітря до сульфур (VІ) оксиду SO3 у присутності каталізатора NO:
|
O2 + 2NO = 2NO2 NO2 + SO2 = SO3 + NO |
|
A + K = AK AK + B = AB + K |
|
O2 + 2SO2 = SO3 |
|
A + B = AB |
Зазначимо, що без каталізатора ця реакція практично не відбувається.
Каталізатори характеризуються специфічністю та універсальністю. Специфічні каталізатори прискорюють лише одну реакцію, для інших неефективні (MnO2 прискорює розклад лише KClO3).
Існують каталізатори із груповою специфічністю. Наприклад V2O5 прискорює окиснення NH3, SO2; Ni – процеси гідрування/дегідрування органічних сполук.
Універсальні каталізатори змінюють швидкість різних реакцій (Рt є каталізатором реакцій окиснення SO2 до SO3 і гідрування ненасичених сполук).
Каталізатори іноді змінюють не лише швидкість, а й напрям проходження реакції. Вище розглянуто різницю у напрямках розкладу KClO3 без MnO2, та у його присутності. Іншим прикладом є каталітичний термоліз етанолу С2Н5ОН. Якщо процес проводити при 30 0С у присутності Al2O3, то продуктами реакції є етан СН2=СН2 і вода Н2О:
СН3–СН3–ОН ![]() СН2=СН2 + Н2О
СН2=СН2 + Н2О
Якщо реакцію проводити при 250 0С у присутності порошку міді Cu, утворюються ацетальдегід СН3СОН і молекулярний водень Н2:
СН3–CH2–ОН ![]() СН3СOН + Н2
СН3СOН + Н2
Використання каталітичних реакції. У хімічній промисловості понад ¾ виробництв базуються на застосуванні каталізаторів. Серед них – виробництва амоніаку, нітратної та сульфатної кислот, різноманітні органічні синтези.
Величезну роль відіграє каталіз у біологічних системах. Більшість реакцій у живих організмах є каталітичними. Біокаталізатори (ферменти або ензими) – це прості або складні білки. Ферменти є високоспецифічними каталізаторами – в організмі людини є понад 3000 ферментів, кожен з яких каталізує лише одну “свою” реакцію.