8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
8. ХІМІЧНА КІНЕТИКА І КАТАЛІЗ
8.3. Необоротні та оборотні хімічні реакції. Хімічна рівновага та її зміщення
Як зазначалось вище, всі хімічні реакції можна поділити на оборотні та необоротні.
Необоротні реакції відбуваються до кінця – поки не буде повністю використаний один з реагентів.
Оборотні реакції ніколи не відбуваються до кінця, тому що жоден з реагентів не витрачається повністю в ході реакції і продукти реакції за певних умов можуть перетворюватись у реагенти.
Розглянемо два приклади.
Взаємодія металічного магнію з хлоридною кислотою відбувається за схемою:
Mg + 2HCl = MgCl2 + H2
Якщо взяти достатню кількість кислоти, то реакція припиниться, коли розчиниться весь магній. Спроба провести зворотну реакцію шляхом пропускання водню Н2 через розчин магній хлориду MgCl2 очікуваного результату не дасть. Таким чином, наведена реакція необоротна.
Хімічні реакції, що відбуваються винятково в одному напрямку називають необоротними.
При нагріванні парів молекулярного йоду І2 з Н2 при 200 0С відбувається реакція:
І2 + Н2 ![]() 2НІ, v1 = k1[Н2][І2]
2НІ, v1 = k1[Н2][І2]
При утворенні газової суміші із вмістом НІ 80%, ця реакція припиняється.
При подальшому нагріванні цієї суміші до 350 0С відбувається розклад утвореного НІ:
2НІ ![]() І2 + Н2 v2 = k2[НІ] 2
І2 + Н2 v2 = k2[НІ] 2
Коли розкладеться 80% йодоводню, реакція припиниться.
Як бачимо, кількісний склад утворених за обома реакціями газових сумішей однаковий.
Очевидно, що у даних умовах не утвориться 100% НІ за першою реакцією і не розкладеться 100% його за другою схемою, оскільки реагенти і продукти можуть перетворюватись одні в одних. Тому ця реакція оборотна.
Хімічні реакції, що при певних умовах можуть відбуватись у протилежних напрямках називають оборотними.
Розглянуті процеси, що відбуваються у випадку НІ можна записати сумарною схемою:
Н2 + І2  2НІ
2НІ
Реакція, що відбувається з ліва на право називається прямою, а справа на ліво – зворотною.
Для реакції І2 + Н2 = 2НІ у початковий момент часу швидкість утворення НІ (прямої реакції) v1 буде максимальною, а швидкість v2 реакції 2НІ = І2 + Н2 (зворотної) буде нульовою, оскільки НІ ще не утворився. З плином часу в реакційній системі буде зростати концентрація НІ і зменшуватись кількість Н2 і І2, тому відповідно буде зростати швидкість v2 і зменшуватись v1 (рис. 8.1).
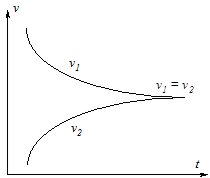
Рис. 8.1. Зміна швидкості прямої (v1) та зворотної (v1) реакцій з плином часу (t).
Коли v1 = v2 настає момент хімічної рівноваги. У стані хімічної рівноваги за певний час утворюється стільки ж молекул продуктів, скільки їх розкладається до регентів.
Стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної називають станом хімічної рівноваги.
Хімічну рівновагу називають динамічною, підкреслюючи цим, що у системі одночасно відбуваються пряма і зворотна реакції з однаковою швидкістю, через що зміни в реакційному середовищі непомітні.
Кількісно стан хімічної рівноваги характеризує константа хімічної рівноваги – відношення констант швидкості прямої k1 і зворотної реакції k2.
У розглянутому прикладі оборотної реакції Н2 + І2 D 2НІ, v1 = v2 і тому k1[Н2][І2] = k2[НІ] 2, і 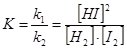 .
.
У загальному випадку для оборотної реакції
aA + bB + … ↔ pP + qQ + …
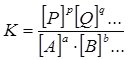
Константа хімічної рівноваги залежить від температури і не залежить від концентрацій компонентів реакції.
Знаючи значення К можна говорити про повноту проходження тієї чи іншої реакції.
При K > 1 рівновага зміщена вправо і в системі переважають продукти реакції.
При К < 1 рівновага зміщена вліво і в системі переважають реагенти.
При К = 0 реакція не відбувається.
Зміщення хімічної рівноваги.
При сталих зовнішніх умовах (тиск, температура, концентрації реагентів) стан рівноваги оборотної реакції може зберігатись нескінченно довго. Насправді, при зміні хоча б одного з вказаних параметрів, швидкості прямої і зворотної реакції змінюються і рівновага зміщується в бік того чи іншого процесу. Через певний час швидкості прямої і зворотної реакцій знову вирівняються і встановиться новий стан хімічної рівноваги з іншими концентраціями компонентів системи.
Закономірності впливу зовнішніх змін на стан хімічної рівноваги в оборотних системах вивчав фр. вчений Ле-Шатель’є і у 1884 р. встановив:
Якщо на систему, що перебуває у стані динамічної рівноваги подіяти ззовні, то у системі відбуватимуться реакції, що зменшують зовнішній вплив.
Ця закономірність названа принципом Ле-Шатель’є.
Розглянемо зміщення хімічної рівноваги за умов зміни концентрацій реагентів і продуктів, температури і тиску на прикладі оборотної реакції синтезу аміаку NH3 з молекулярних водню H2 та азоту N2:
N2(г) + 3H2(г) ↔ 2NH3(г), ΔН = 92 кДж
Зміна концентрації реагентів у бік її збільшення веде до зростання швидкості прямої реакції утворення аміаку і зв’язування реагентів. Зменшення концентрації реагентів викликає проходження зворотної реакції. Аналогічно (але в протилежному напрямку) впливає зміна концентрації продуктів реакції.
Зміна температури. Оскільки пряма реакція є екзотермічна, то зворотна – ендотермічна. При підвищенні температури рівновага зміщується в бік ендотермічної реакції (розклад аміаку), а при зниженні – екзотермічної (утворення NH3).
Зміна тиску впливає на стан хімічної рівноваги реакцій, що відбуваються у газовій фазі, оскільки зумовлює зміну об’єму системи і відповідно концентрації компонентів. У розглянутому прикладі пряма реакція веде до зменшення об’єму системи (з 2 об’ємів азоту та 3 об’ємів водню утворюється 2 об’єми аміаку) і відповідно до зменшення тиску в реакторі, а зворотна – до збільшення об’єму і тиску.
Отже, при зростанні тиску хімічна рівновага зміщується у бік менших об’ємів, а при зменшенні – у бік більших.
Якщо реакція відбувається у газовій фазі без зміни об’єму, то зміна тиску в системі на стан хімічної рівноваги не впливає (Н2 + І2 ↔ 2НІ).
Як зазначалось вище, каталізатори однаково змінюють швидкість прямої і зворотної реакції, тому на стан хімічної рівноваги вони не впливають, а лише прискорюють момент її настання.