11. РОЗЧИНИ
11. РОЗЧИНИ
11.5. Способи вираження складу розчинів
Важливою характеристикою будь-якого розчину є його склад. Склад розчину можна описати з якісного і з кількісного боку.
Для якісної характеристики розчинів використовують поняття “розведений” (містить відносно невелику кількість розчиненої речовини) і “концентрований” (містить відносно велику кількість розчиненої речовини).
Хімікам при роботі з розчинами необхідно знати їх кількісний склад, який виражається різними величинами.
Кількісно склад розчинів виражають через безрозмірні відносні величини – частки (масову, об’ємну, молярну) і розмірні величини – концентрації (масову, молярну, молярну концентрацію еквівалента).
Частка показує відносну кількість компонента, порівняно із загальною кількістю розчину.
Концентрація показує відношення маси (об’єму або кількості розчиненої речовини) до об’єму (маси) розчину або розчинника.
Розглянемо докладніше вираження складу розчинів у частках. Введемо позначення: m – маса розчину, V – об’єм розчину, r – густина розчину, mS – маса розчинника, mB – маса розчиненої речовини, VB – об’єм розчиненої речовини, nB – кількість моль розчиненої речовини, ![]() – кількість речовини еквівалента розчиненої речовини.
– кількість речовини еквівалента розчиненої речовини.
- Масова частка (ω – омега) – відношення маси компонента mB до маси розчину m:
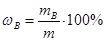 . Виражається у частках від одиниці або у відсотках. Так, запис «масова частка H2SO4 у водному розчині становить 15%», означає, що у 100 г розчину сульфатної кислоти міститься 15% H2SO4 і 85% води.
. Виражається у частках від одиниці або у відсотках. Так, запис «масова частка H2SO4 у водному розчині становить 15%», означає, що у 100 г розчину сульфатної кислоти міститься 15% H2SO4 і 85% води. - Об’ємна частка (φ – фі) – відношення об’єму компонента VB до об’єму розчину V:
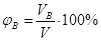 . Виражається у частках від одиниці або у відсотках. Найчастіше використовується для характеристики складу газових сумішей і розчинів, утворених кількома рідинами. Наприклад, склад повітря в об’ємних частках: 21% кисню О2 і 79% азоту N2.
. Виражається у частках від одиниці або у відсотках. Найчастіше використовується для характеристики складу газових сумішей і розчинів, утворених кількома рідинами. Наприклад, склад повітря в об’ємних частках: 21% кисню О2 і 79% азоту N2. - Молярна частка (χ – хі) – відношення кількості моль компонента νB до сумарної кількості компонентів Σν:
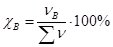 . Виражається у частках від одиниці або у відсотках.
. Виражається у частках від одиниці або у відсотках.
Оскільки переважна кількість розчинів – рідкі, їх зручніше вимірювати за об’ємом, а не за масою, тому у хімії частіше застосовують об’ємні концентрації.
- Молярна концентрація (С – це, молярність) – відношення кількості моль розчиненої речовини νB до об’єму розчину V:
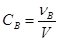 . Оскільки [νB] = моль, а [V] = л, то [С] = моль/л = М.
. Оскільки [νB] = моль, а [V] = л, то [С] = моль/л = М.
Існують загальноприйняті назви розчинів різної молярної концентрації:
1 моль/л – 1 М – одномолярний;
2 моль/л – 2 М – двомолярний;
0,1 моль/л – 0,1 М – децимолярний;
0,02 моль/л – 0,02 М – двосантимолярний;
0,003 моль/л – 0,003 М – тримілімолярний.
2. Масова концентрація (ρ – ро) – відношення маси розчиненої речовини mB до об’єму розчину V: ![]() . Якщо [m] = г (кг), а [V] = л (м3), то [ρ] = г/л (кг/м3).
. Якщо [m] = г (кг), а [V] = л (м3), то [ρ] = г/л (кг/м3).
Для двокомпонентних розчинів числові значення масової концентрації та густини збігаються.
3. Молярна концентрація еквівалента (Сн – це ен, нормальна концентрація, нормальність) – відношення кількості моль еквівалентів розчиненої речовини ![]() , до об’єму розчину V:
, до об’єму розчину V: ![]() . Розмірність така ж як у молярної концентрації.
. Розмірність така ж як у молярної концентрації.
На основі співвідношення для обчислення молярної концентрації еквівалента і наслідку із закону еквівалентів, можна записати:
![]() ,
, ![]() або
або ![]() ,
,
де ![]() і
і ![]() – нормальності розчинів реагентів, у розчинах об’ємом відповідно VB і VA.
– нормальності розчинів реагентів, у розчинах об’ємом відповідно VB і VA.
На основі одержаної залежності можна обчислити потрібні для реакції об’єми розчинів реагентів, і навпаки, знаючи їх об’єми, визначити концентрації. Розрахунки такого типу здійснюють в аналітичній хімії при визначенні концентрацій розчинів методами титриметрії.
Знаючи ![]() (фактор еквівалентності речовини В) можна перейти від Сн до СB і навпаки: СВ =
(фактор еквівалентності речовини В) можна перейти від Сн до СB і навпаки: СВ = ![]() Сн. Це відношення легше запам’ятати, знаючи, що Сн не може бути меншими від СВ.
Сн. Це відношення легше запам’ятати, знаючи, що Сн не може бути меншими від СВ.
Інші назви розчинів різної нормальності:
1н. – 1 моль-екв./л – однонормальний розчин;
0,1н. – 0,1 моль-екв./л – децинормальний розчин;
0,02 н. – 0,02 моль-екв./л – двосантинормальний розчин.
Окреслені вище положення узагальнено в табл. 11.3.
Таблиця 11.3.
Способи вираження концентрації розчинів
|
Характеристика |
Частка |
Концентрація |
|||
|
Масова |
Об’ємна |
Молярна |
Масова |
Об’ємна |
|
|
Символ |
ω | φ | χ | ρ |
СВ, Сн |
|
Рівняння |
|
|
|
|
|
|
Одиниці вимірювання |
частка від 1 або % |
частка від 1 або % |
частка від 1 або % |
кг/м3, г/л, |
моль/м3, |