12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
12.2. Механізм електролітичної дисоціації
Механізм електролітичної дисоціації пояснив у 1891 р. І.А. Каблуков, об’єднавши для цього хімічну теорію розчинів Д.І. Менделєєва та фізичну С. Арреніуса.
Згідно з фізико-хімічною теорією Каблукова, молекули розчинника взаємодіють з молекулами та іонами розчиненої речовини з утворенням нестійких сполук – сольватів (у випадку, коли розчинник вода – гідратів).
Процес розпаду на іони сполук з іонним зв’язком можна представити так: будь-який іон, який перебуває на поверхні кристала, утворює навколо себе електростатичне поле (катіон – позитивне, аніон – негативне). Внаслідок сил притягання полярні молекули води (диполі) орієнтуються відносно кристала так, що позитивна сторона молекули води підходить до негативного поля аніона, а негативна – до позитивного (катіона). В результаті іон-дипольної взаємодії виділяється енергія, що веде до розриву іонних зв’язків у кристалі і переходу іонів у розчин, де їх утримують молекули води (гідратація) (рис. 10.1).
У випадку розчинення полярної молекули HCl (диполь) у воді, орієнтація молекул розчинника (Н2О) навколо молекул HCl відбувається як в іонних сполук. У результаті диполь-дипольної взаємодії електронна хмара, що утворює хімічний зв’язок зміщується до атома хлору, а ковалентний зв’язок перетворюється в іонний – відбувається іонізація зв’язку (рис. 12.1).
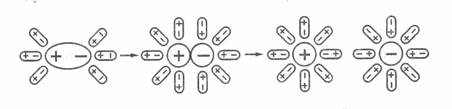
Рис. 12.1. Схема електролітичної дисоціції
Гідратовані іони Н+ записують формулою Н3О+ (точніше Н3О+*nН2О, де n = 0 – 4) і називають іони гідроксонію:
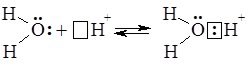
Загальна схема дисоціації електроліту складу KtnAnm:
KtnAnm + xH2O → nKt+∙yH2O + mAn–∙(x – y)H2O,
або без урахування процесу гідратації:
KtnAnm → nKt+ + mAn–.
Останнє рівняння не показує ролі води в процесі дисоціації і тому не розкриває механізм процесу.
Роль розчинника у процесі електролітичної дисоціації проілюструємо прикладом. На відміну від водного розчину HCl, розчин його у бензені С6Н6 не проводить електричний струм, оскільки полярні молекули HCl не дисоціюють у неполярному розчиннику. Отже, дисоціація відбувається лише у полярних розчинниках (вода Н2О, рідкий амоніак NH3, ацетатна кислота СН3СООН тощо).
Іони за фізичними та хімічними властивостями відрізняються від атомів, з яких вони утворені, що пояснюється різною будовою електронних оболонок відповідних атомів та іонів. Іони перебувають у стійкіших електронних конфігураціях, ніж атоми.
У розчинах іони s- i p-елементів зазвичай безбарвні, іони d-елементів забарвлені. Гідратовані і негідратовані іони одного і того ж елемента різноманітно забарвлені: тверді солі кобальту (ІІ) – білого кольору, їх розчини – рожеві (іони Co2+∙nH2O).