12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
12. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
12.3. Ступінь дисоціації. Фактори, що впливають на ступінь дисоціації
Для кількісної характеристики електролітичної дисоціації використовують поняття ступінь дисоціації – відношення кількості молекул, що розпались на іони (n) до вихідної кількості молекул (N):
![]()
де a (альфа) – безрозмірна величина, виражається у частках від одиниці або у %.
Якщо електроліт дисоціює повністю, то a = 1 або 100%. Для неелектролітів a = 0 або 0%.
Ступінь дисоціації ацетатної кислоти СН3СООН у 0,01 М водному розчині при 18 0С становить 4,3×10-2 або 4,3%. Це означає, що із 1000 розчинених молекул СН3СООН лише 43 розпадаються на іони за схемою:
СН3СООН ↔ СН3СОО– + Н+
утворюючи при цьому 43 катіони Н+ та 43 аніони СН3СОО–, а решта 957 молекул СН3СООН перебувають у недисоційованому стані.
Ступінь дисоціації залежить від природи розчиненої речовини, розчинника, температури розчину та його концентрації і наявності у розчині інших електролітів.
Розглянемо докладніше вплив цих факторів.
Природа розчиненої речовини суттєво впливає на ступінь дисоціації. Так, ступінь дисоціації 0,1 М водного розчину HClO (0,055%) набагато менший ніж ступінь дисоціації 0,1 М водного розчину СН3СООН (4,3%) за тих же умов.
Природа розчинника. У полярних розчинниках (вода, ацетатна кислота) електролітична дисоціація відбувається в різній мірі. Так. у водних розчинах ступінь дисоціації тих же речовин вищий, ніж у оцтовокислих. Інший приклад – у водному розчині ацетатна кислота дисоціює, а у бензені С6Н6 – перебуває у недисоційованому стані.
Зі зростанням температури ступінь дисоціації, як правило, зростає за рахунок послаблення іонних зв’язків у молекулах електролітів.
При зменшенні концентрації електроліту, тобто при розведенні розчину, ступінь дисоціації зростає, оскільки зростають відстані між іонами в розчині і зменшується ймовірність об’єднання їх в молекули.
Наявність у розчині інших електролітів. Згідно з принципом Ле-Шательє при зростанні концентрації однойменних іонів у розчині електроліту ступінь дисоціації зменшується. Так, при додаванні до водного розчину ацетатної кислоти СН3СООН ацетату натрію СН3СООNa, рівновага зміщується у бік недисоційованих молекул кислоти:
СН3СООН ↔ СН3СОО– + Н+
СН3СООNa → СН3СОО– + Na+.
Аналогічний ефект буде при підкисленні розчину, що веде до зростання концентрації катіонів Н+.
Якщо ж до вихідного розчину кислоти додати лугу (NaOH), то ступінь дисоціації зросте, оскільки з реакційного середовища виводяться іони Н+:
СН3СООН + ОН– ↔ СН3СОО– + Н2О.
За величиною ступеня дисоціації електроліти поділяють на сильні, слабкі та середньої сили.
Електроліти, ступінь дисоціації яких у відносно концентрованих розчинах становить понад 30% називають сильними. Вони практично повністю дисоціюють на іони у розчинах будь-якої концентрації. До них відносять більшість солей, мінеральних кислот, лугів.
Електроліти, ступінь дисоціації яких у відносно розведених розчинах становить менше 3% називають слабкими. До них відносять більшість органічних і деякі мінеральні (HClO, H2S, H2CO3) кислоти, нерозчинні основи (Al(OH)3, Zn(OH)2, NH4OH). Вода теж є слабким електролітом.
Електроліти, ступінь дисоціації яких більший ніж 3% та менший ніж 30% – середньої сили. Вони практично повністю дисоціюють на іони у розчинах будь-якої концентрації. Це – деякі неорганічні кислоти (H2SO3, H3PO4, HNO2) та основи (Mg(OH)2).
Визначити силу мінеральної оксигеновмісної кислоти можна за формулою Е(ОН)nОm, де Е – центральний атом. Якщо m < 2, кислота слабка, m ³ 2 – сильна (табл. 12.1). Це пояснюється тим, що атоми Оксигену відтягують на себе спільні електронні пари і електронна густина від ОН-груп зміщується до атома кислотоутворючого елемента, зв’язок Н–О в ОН-групі стає полярнішим:
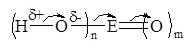
Чим поляризованіший зв’язок, тим він слабший і тому кислота сильніша.
Таблиця 12.1
Сила кислот складу Е(ОН)nОm
|
Формула |
Е(ОН)nОm |
m |
Сила кислоти |
|
HNO2 HNO3 H2SO3 H2SO4 HClO HClO4 |
N(OH)O N(OH)O2 S(OH)2O S(OH)2O2 Cl(OH) Cl(OH)O3 |
1 2 1 2 0 3 |
слабка сильна слабка сильна дуже слабка дуже сильна |