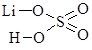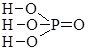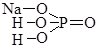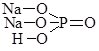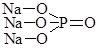13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13.7. Солі
Солі – складні речовини, утворені катіонами металів (Men+) або амоніаку NH4+ та аніонами кислотних залишків Anm–: MemAnn, де n i m – відповідно заряди катіона та аніона.
Класифікація солей.
Солі можна розглядати як продукти заміщення атомів Гідрогену у молекулах кислоти на катіони металу або амоніаку, або гідроксогруп в основах на аніони кислотних залишків (див. схема 13.1).
Якщо заміщення повне, утворюються нормальні (середні) солі:
Н2SO4 + 2NaOH = Na2SO4 + 2H2O,
Ca(OH)2 + 2HCl = CaCl2 + 2H2O.
До простих солей також відносять пероксиди металів (Na2O2, ВаО2), бінарні сполуки металів з неметалами (крім оксидів), змішані оксиди (Fe3O4 = Fe(FeO2)2, Pb3O4 = Pb(PbO2)2 тощо).
У випадку неповного заміщення атомів Гідрогену у молекулі кислоти, утворюються кислі солі:
Н3РO4 + NaOH = NaН2РO4 + H2O.
Кислі солі утворюють лише багатоосновні кислоти (Н2СO3, Н2С2O4, Н2SO4, Н2S, Н3РO4 тощо).
При неповному заміщенні гідроксогруп у молекулі основи, утворюються основні солі:
Al(OH)3 + 2HCl = (AlOH)Cl2 + 2H2O.
Основні солі утворюють лише багатокислотні основи (Ca(OH)2, Al(OH)3, Fe(OH)2, Fe(OH)3 тощо).
Змішані солі утворені одним катіоном металу і аніонами різних кислот:
Ca(ОН)(OCl) + HCl = Ca(OCl)Cl + H2O.
Подвійні солі утворені різними катіонами і аніоном однієї кислоти:
KHSO4 + NaOH = KNaSO4 + H2O.
Особливий тип солей – комплексні сполуки, розглянуто нижче.
Номенклатура солей.
Назву солям дають у порядку запису складових частин у формулі: спочатку назва катіона, потім – аніона у родовому відмінку: NaCl – натрій хлорид, CaS – кальцій сульфід.
У випадку катіонів металів зі змінною валентністю, після їх назви у родовому відмінку римською цифрою вказують у дужках валентність катіона: FeSO4 – ферум (ІІ) сульфат, CrCl3 – хром (ІІІ) хлорид.
У назвах кислих солей використовують префікс гідроген-, зазначаючи при цьому кількість атомів гідрогену: NaHCO3 – нaтрій гідрогенкарбонат, Ca(H2PO4)2 – кальцій дигідрогенфосфат.
У назвах основних солей використовують префікс гідроксо-, зазначаючи при цьому кількість гідроксогруп: Са(ОН)Br – кальцій гідроксобромід, Al(OH)2Cl – алюміній дигідроксохлорид.
Назви катіонів або аніонів подвійних чи змішаних солей перелічують у порядку запису їх у формулі: KAl(SO4)2 – калій алюміній сульфат, NH4Fe(SO4)2 – амоній ферум (ІІІ) сульфат, Ca(OCl)Cl – кальцій гіпохлорит хлорид, BiSCl – бісмут (ІІІ) сульфід хлорид.
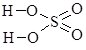
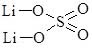
Записуючи графічні формули солей, за основу беруть графічні формули відповідних кислот, заміщуючи у них атоми Гідрогену на катіони металу (табл. 13.9).
Таблиця 13.9
Графічні формули деяких солей
|
Кислота |
Графічна формула |
Кисла сіль |
Середня сіль |
|
|
Сульфідна Н2S |
|
калій гідрогенсульфід |
калій сульфід |
|
|
Сульфатна Н2SО4 |
|
літій гідрогенсульфат |
літій сульфат |
|
|
Фосфатна Н3РО4 |
|
натрій дигідрогенфосфат |
натрій гідрогенфосфат |
натрій фосфат |
Способи одержання солей.
Найважливіші реакції одержання солей розглянуті при описі оксидів, основ та кислот. Узагальнює їх схема 13.3, яка одночасно показує генетичний зв’язок між оксидами, кислотами, основами та солями.
Схема 13.3
Генетичний зв’язок між основними класами неорганічних сполук
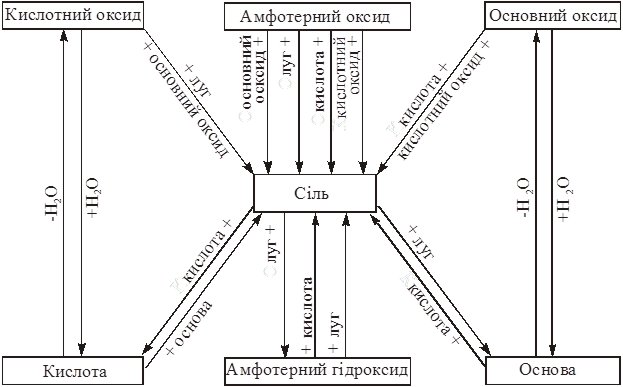
Солі також можна добути взаємодією:
1. простих речовин металу і неметалу:
2K + Cl2 = 2KCl, Fe + S = FeS.
2. металів із кислотами:
Mg + 2HCl = MgCl2 + H2, Fe + H2SO4 = FeSO4 + H2.
3. металів із солями:
Сu + HgCl2 = CuCl2 + Hg↓, Fe + CuSO4 = FeSO4 + Cu↓.
4. солей із солями:
Ba(NO3)2+ Na2SO4 = BaSO4↓ + 2NaNO3, NH4Cl+ AgNO3 = NH4NO3 + AgCl↓.
5. солей з основами:
СuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4, FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl.
6. солей з кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O, FeS + 2HNO3 = Fe(NO3)2 + H2S.
7. термолізом солей:
2NaHCO3 = Na2CO3 + H2O + CO2, 2KNO3 = 2KNO2 + O2.
Існує ще багато способів одержання солей, але при виборі того чи іншого способу, перш за все слід враховувати його раціональність.
Кислі солі одержують тими ж методами, що й середні, однак при цьому беруть значний надлишок кислотного компонента:
NaOH + H2SO4 = NaHSO4 + H2O, Ca(OH)2 + CO2 = Ca(HCO3)2.
Діючи кислотою на середню сіль, можна перетворити її у кислу:
K3PO4 + 2H3PO4 = 3KH2PO4, Na2CO3 + HCl = NaHCO3 + NaCl.
Основні солі одержують аналогічно, але у надлишку беруть основу:
Ca(OH)2 + HCl = Ca(OH)Cl, 2Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O.
Діючи основою на середню сіль, можна перетворити її в основну:
Al2(SO4)3 + 2NaOH = 2Al(OH)(SO4) + Na2SO4,
Bi(NO3)3 + 2KOH = Bi(OH)2NO3 + 2KNO3.
Подвійні солі одержують дією іншої кислоти на основну сіль:
Ca(OH)Cl + HClO = Ca(OCl)Cl + H2O.
Змішані солі утворюються при дії на кислі солі інших лугів:
KHSO4 + NaOH = KNaSO4 + H2O.
Одержання комплексних солей див. Комплексні сполуки.
Фізичні властивості солей.
За нормальних умов усі солі – тверді кристалічні речовини з високими температурами плавлення. Тип хімічного зв’язку – іонний. Забарвлення солей змінюється від безбарвного до темно-коричневого.
За розчинністю у воді виділяють легкорозчинні (NaCl, NH4NO3), важкорозчинні (PbCl2, CaSO4) і нерозчинні (AgCl, CaCO3, BaSO4) (див. Розчинність).
Хімічні властивості солей.
Солі взаємодіють з металами, неметалами, кислотами, основами і між собою. Ці реакції розглянуті при вивченні способів одержання солей.
Важливою хімічною властивістю солей є їх гідроліз.
Гідроліз солей.
Раніше показано (див. рН), що чиста вода має нейтральне середовище (рН = 7), водні розчини кислот створюють кисле (рН < 7), а основ – лужне (рН > 7) середовище.
Водні розчини солей мають різне значення рН. Так, водні розчини NaCl, KNO3 мають рН = 7, Na2CO3, CH3COONa – pH > 7, NH4Cl, FeSO4 – pH < 7. Причиною цього є гідроліз.
Гідроліз – реакція обміну солі з водою, в результаті якої утворюються малодисоційовані або малорозчинні сполуки.
Залежно від сили кислот та основ, які утворили сіль, виділяють 4 типи солей, гідроліз яких відбувається по-різному:
- утворені сильною кислотою і сильною основою;
- утворені сильною кислотою і слабкою основою;
- утворені слабкою кислотою і сильною основою;
- утворені слабкою кислотою і слабкою основою.
Розглянемо детально гідроліз перелічених типів солей.
1. Солі, утворені сильною кислотою і сильною основою (NaCl, KNO3).
У водному розчині NaCl відбувається процес:
NaCl ↔ Na+ + Cl–
2. Солі, утворені сильною кислотою і слабкою основою (СuCl2, FeSO4).у результаті його не утворюються слабкі електроліти чи малорозчинні сполуки, тому гідроліз не відбувається і у розчинах таких солей рН = 7.
Якщо гідролізу піддається сіль, утворена багатоосновною кислотою чи багатокислотною основою, процеси відбуваються ступінчато.
Гідроліз CuCl2. Спочатку сіль дисоціює:
СuCl2 ↔ Cu+ + 2Cl–
|
I ступінь: |
Cu2+ + H2O ↔ Cu(OH)+ + H+ CuCl2 + H2O ↔ Cu(OH)Cl + HCl |
|
|
II ступінь: |
Cu(OH)+ + H2O ↔ Cu(OH)2 + H+ Cu(OH)Cl + H2O ↔ Cu(OH)2 + HCl |
|
|
Сумарно |
CuCl2 + 2H2O ↔ Cu(OH)2↓ + 2HCl |
|
У результаті реакції утворюється малодисоційована сполука Cu(OH)2 і створюється надлишок катіонів Н+, тому середовище кисле – рН < 7.
Гідроліз солей такого типу називають ще гідролізом по катіону оскільки слабкий електроліт утворюється за участю саме катіону (у нашому випадку Сu2+).
3. Солі, утворені слабкою кислотою і сильною основою (NaNO2, K2S).
Гідроліз K2S проходить у 2 ступені. Спочатку сіль дисоціює:
K2S ↔ 2K+ + S2–.
|
I ступінь: |
S2– + H2O ↔ HS– + OH– K2S + H2O ↔ KHS + KOH |
|
|
II ступінь: |
HS– + H2O ↔ H2S + OH– KHS + H2O ↔ H2S + KOH |
|
|
Сумарно |
K2S+ 2H2O ↔ H2S + 2KOH |
|
У результаті реакції утворюється малодисоційована сполука H2S і створюється надлишок аніонів ОН–, тому середовище лужне – рН > 7.
Гідроліз солей такого типу називають ще гідролізом по аніону оскільки слабкий електроліт утворюється за його участю (у нашому випадку S2–).
В обох випадках гідроліз максимально відбувається за І ступенем.
Як правило, гідроліз – оборотний процес, проходженню реакції до кінця перешкоджає зворотна реакція нейтралізації утвореної кислоти (або основи) аніонами ОН– (або катіонами Н+).
4. Солі, утворені слабкою кислотою і слабкою основою (CaC2, Ca3P2, Al2S3, (NH4)2CO3, NH4CN, CH3COONH4) гідролізують необоротно:
Al2S3 + 6Н2О = 2Al(OH)3↓ + 3H2S.
Гідроліз відбувається одночасно по катіону і по аніону, рН = 7.
У випадку гідролізу NH4CN, CH3COONH4, рН розчину залежить від сили утворених кислоти (рКа) та основи (pКb). У реакції
CH3COONH4 + Н2О = CH3COOН + NH4ОН,
рКа(CH3COOH) = рКb(NH4ОН) = 4,75, тому середовище нейтральне (рН = 7).
Отже, рН водного розчину солі визначає сильний електроліт, іони якого входять до складу солі, що гідролізує.
На процес гідролізу впливає концентрація солі і температура.
Згідно принципу Ле-Шательє, розбавлення розчину рівноцінне збільшенню концентрації одного з реагентів – води, тому рівновага зміщується вправо і гідроліз посилюється.
Зміна температури впливає на ступінь дисоціації води. Зі зростанням температури кількість іонів Н+ і ОН– у розчині зростає, тому збільшується ймовірність взаємодії їх з іонами, утвореними при дисоціації молекул солі, з утворенням малодисоційованої кислоти чи основи. Тому при нагріванні гідроліз відбувається повніше.
Кількісно гідроліз характеризує ступінь гідролізу h – відношення концентрації гідролізованих молекул N1 до загальної концентрації солі N0:
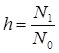 .
.