13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13. ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ РЕЧОВИН
13.8. Комплексні сполуки
Як зазначалось раніше, у результаті деяких реакції утворюються сполуки, будова і властивості яких однозначно не входять у розглянуті нами досі класи неорганічних речовин.
Ці речовини відносять до комплексних сполук. Утворюються вони при взаємодії простих неорганічних речовин – солей, кислот, основ:
FeCl2 + 6KCN = K4[Fe(CN)6] + 2KCl, Al(OH)3 + 3NaOH = Na3[Al(OH)6],
AgNO3 + 2NH3 = [Ag(NH3)2]NO3, Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O.
Основи вчення про комплексні сполуки заклав А. Вернер у 1893 р. Згідно його координаційної теорії кожна комплексна сполука містить комплексний іон, утворений центральним атомом – комплексоутворювачем та розміщеними навколо нього лігандами – нейтральними молекулами або іонами. Загальна кількість зв’язків центрального атома з лігандами – його координаційне число. Комплексоутворювач і ліганди утворюють внутрішню сферу комплексу, або комплексний іон, який при написанні виділяють квадратними дужками. За межами комплексного іона розміщена зовнішня сфера, утворена катіонами або аніонами. Існують комплексні сполуки без зовнішньої сфери.
Проілюструємо сказане схемою:
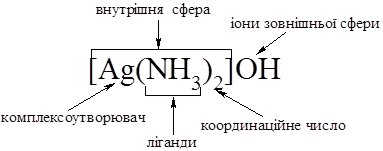
На основі будови комплексних сполук базується їх сучасне визначення.
Комплексними називають складні сполуки, які містять комплексний іон, що складається із комплексоутворювачів і лігандів та здатний до самостійного існування у розчині і /або в розплаві.
Типовими комплексоутворювачами є d- та f-елементи і їх катіони: Cr, Fe, Mn, Ag+, Cu2+, Hg2+, Zn2+, Cr3+, Fe2+, Fe3+, Co3+, Ni2+, Pt4+ тощо.
Катіони s- i p-елементів (Be2+, Al3+, Sn4+, Pb4+) та атоми неметалів (N, P, Si, B) теж можуть бути комплексоутворювачами.
Лігандами можуть бути нейтральні молекули (H2O, CO, NH3, C6H6) або аніони кислот. У складі ліганду обов’язково має бути атом з неподіленою електронною парою.
Внутрішня сфера комплексних сполук може бути нейтральною або зарядженою (позитивно чи негативно):
[Ni(CO)4] – нейтральна внутрішня сфера;
K4[Fe(CN)6] – негативно заряджена внутрішня сфера (комплексний аніон);
[Ag(NH3)2]Сl – позитивно заряджена внутрішня сфера (комплексний катіон).
Якщо внутрішня сфера нейтральна, зовнішньої сфери немає. Якщо ж заряджена, то зовнішня сфера має такий же заряд, протилежний за знаком. Найчастіше зовнішню сферу утворюють катіони лужних, лужноземельних металів, амонію, аніони безоксигенових, оксигеновмісних кислот, гідроксогрупи ОН–.
Розглянемо механізм виникнення хімічних зв’язків між комплексоутворювачем і лігандами на прикладі [Zn(NH3)4]Cl2.
Будова зовнішнього електронного рівня атома Zn зображається формулою 3d104s2, а іона Zn2+ – 3d104s0:
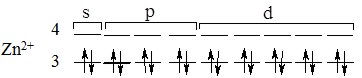
На зовнішньому електронному рівні іона Zn2+ є вільні орбіталі, які можуть бути задіяні в утворенні хімічних зв’язків за донорно-акцепторним механізмом. Для утворення чотирьох таких зв’язків використовується одна s- і три р-орбіталі четвертого електронного рівня іона Zn2+.
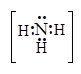 Молекули NH3 (ліганди) несуть неподілену електронну пару на атомі Нітрогену, яку вони надають як донори для утворення зв’язків з іоном Zn2+ – акцептором.
Молекули NH3 (ліганди) несуть неподілену електронну пару на атомі Нітрогену, яку вони надають як донори для утворення зв’язків з іоном Zn2+ – акцептором.
Таким чином, між іонами Zn2+ і молекулами NH3 виникає чотири зв’язки за донорно-акцепторним механізмом:
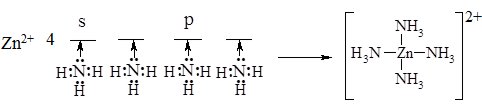
За цим механізмом утворюються зв’язки в усіх комплексних сполуках. Зв’язок між внутрішньою і зовнішньою сферами утворюється за іонним механізмом.
У водних розчинах комплексні сполуки (крім тих, що складаються лише з внутрішньої сфери) дисоціюють практично повністю і є сильними електролітами:
K2[PtCl6] ↔ 2K+ + [ PtCl6]2–; [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl–.
Комплексні іони дисоціюють дуже незначною мірою за першим ступенем, а за кожним наступним ще менше:
І ступінь: [Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3;
ІІ ступінь: [Ag(NH3)]+ ↔ Ag+ + NH3.
Координаційну формулу комплексної сполуки можна встановити реакціями подвійного обміну. Так, Платина Pt утворює комплексні сполуки складу PtCl4×6NH3, PtCl4×4NH3, PtCl4×2NH3, PtCl4×2KCl. Якщо на розчини цих сполук подіяти AgNO3, то осад AgCl утвориться лише у перших двох випадках, причому у другому буде осаджено лише ½ хлору. Очевидно, що у сполуці PtCl4×6NH3 всі атоми хлору містяться у зовнішній сфері, і її формула [Pt(NH3)6]Cl4. Аналогічно у PtCl4×4NH3 у зовнішній сфері міститься два атоми хлору і її формула [Pt(NH3)4Cl2]Cl2. Сполука PtCl4×2NH3 має формулу [Pt(NH3)6Сl4]. У розчині PtCl4×2KCl можна виявити іони К+, тобто її формула К2[PtCl6].
Комплексні сполуки застосовують як реагенти в аналітичній хімії. Велика роль природних комплексних сполук у процесах фотосинтезу (хлорофіл – комплексна сполука магнію), біологічного окиснення, дихання та ферментативного каталізу (гемоглобін – комплексна сполука Феруму (ІІІ)). Вітамін В12 – комплексна сполука кобальту (ІІ).