17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17.5. Сульфур. Сірка
Будова атома.
На зовнішньому енергетичному рівні атома Сульфуру є незаповнений 3d-підрівень і внаслідок збудження атома розпаровані електрони можуть переходити на нього:
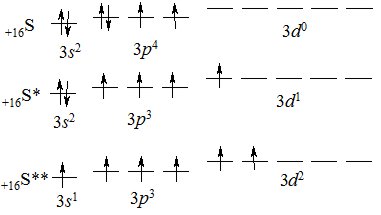
Згідно з кількістю неспарених електронів, атом Сульфуру може виявляти ступені окиснення –2, 0, +4, +6.
Будова речовини.
Сірка має кілька алотропних модифікацій. Найважливішими і найстійкішими є α-сірка (ромбічна) і β-сірка (моноклинна). Вони відрізняються формою кристалів і фізичними властивостями. α- і β-модифікації сірки побудовані з молекул S8 (рис. 17.5).
![]()
Рис. 17.5. Форма молекули S8.
При швидкому охолодженні розплавленої сірки утворюється нестійка пластична сірка, яка складається з полімерних молекул Sх. В парах сірки існують молекули S8, S6, S4, S2 та вільні атоми S.
Фізичні властивості.
Сірка – тверда речовина жовтого кольору. Ромбічна сірка плавиться при 112,80С, моноклинна – при 119,30С. Густина їх – 2,07 г/см3 та 1,96 г/см3 відповідно. Сірка нерозчинна у воді, добре розчинна у сірковуглеці CS2, бензені C6H6 та інших органічних розчинниках.
Добування.
У природі сірка знаходиться у самородному стані та у формі сполук: FeS2 – пірит, FeS – залізний колчедан, ZnS – цинкова обманка, CaSO4 – гіпс тощо.
У лабораторії сірку можна одержати:
1. при неповному згорянні H2S:
2H2S + O2 = 2S + 2H2O,
2. дією сульфатної кислоти на тіосульфати:
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2↑ + S↓
У промисловості сірку добувають методом Фраша – розплавляючи підземні поклади сірки перегрітою водяною парою з подальшою очисткою одержаного продукту – технічної сірки. Таким способом видобувають сірку в Україні, біля м. Новояворівськ (Львівська обл.).
Хімічні властивості.
У формі простої речовини сірка може бути окисником (відновлюватись до ступеня окиснення –2) або відновником (окиснюватись до ступенів окиснення +4 і +6). Сірка не реагує лише з азотом та благородними металами.
Окисні властивості.
1. З металами реагує при нагріванні, з утворенням сульфідів:
2Na + S = Na2S, Fe + S = FeS.
З ртуттю реакція іде за н. у.:
Hg + S = HgS,
що використовують для знешкодження розлитої ртуті (демеркуризації).
2. З неметалами:
S + H2 = H2S 2S + C ![]() CS2, 5S + 2P = P2S5.
CS2, 5S + 2P = P2S5.
Тіоангідрид фосфатної кислоти P2S5 використовують для добування кислот, з лугами він утворює солі.
3. З лугами при нагріванні (реакція диспропорціювання):
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O.
Відновні властивості.
1. З киснем:
S +O2 = SO2.
2. З галогенами (з F2 за н. у., з Cl2 при нагріванні):
S +2F2 = SF4, 2S +Cl2 = S2Cl2.
3. З розбавленою нітратною кислотою:
3S + 4HNO3 = 3SO2 + 4NO + 2H2O, S + 2HNO3 = H2SO4 + 2NO.
4. З концентрованими нітратною та сульфатною кислотами:
S + 6HNO3 = H2SO4 + 6NO + 2H2O, S + 2H2SO4 = SO2 + 2H2O.
Використання.
Сірку використовують для одержання сульфур (IV) оксиду SO2 (проміжного продукту у виробництві сульфатної кислоти), сульфатної кислоти H2SO4, гідроген сульфіду Н2S, сірковуглецю CS2 – поширеного розчинника. Застосовують при вулканізації гуми, одержанні проміжних продуктів у виробництві синтетичних миючих засобів, пороху, косметичних кремів та ліків, засобів захисту рослин.