17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17. ЕЛЕМЕНТИ VIА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ХАЛЬКОГЕНІВ
17.7. Оксиди сульфуру (IV) та сульфуру (VI)
Сульфур утворює два оксиди: SO2 (ступінь окиснення Сульфуру +4) та SO3 (+6). Молекула SO2 – кутова (а), SO3 – трикутна (б):
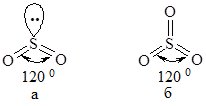
Інші назви SO2 – сульфур діоксид, сірчистий газ, сульфітний ангідрид; SO3 – сульфур триоксид, сульфатний ангідрид.
Одержання.
У лабораторії сульфур діоксид одержують:
1. Дією розбавленої хлоридної або сульфатної кислот на сульфіти чи гідрогенсульфіти лужно-земельних металів:
2KHSO3 + H2SO4 = 2SO2 + K2SO4 + 2H2O.
2. Реакцією міді з концентрованою сульфатною кислотою при нагріванні:
Cu + 2H2SO4 = SO2 + CuSO4 + H2O.
У промисловості сульфур діоксид одержують випалюванням сульфідів:
4FeS2 + 11O2 = 8SO2 + 2Fe2O3, 2PbS + 3O2 = 2SO2 + 2PbO.
Сульфур триоксид у промисловості одержують спалюванням сульфур діоксиду у присутності V2O5:
2SO2 + O2 ![]() 2SO3.
2SO3.
Фізичні властивості.
Сульфур (IV) оксид – безбарвний газ, з різким запахом, при 10 0С зріджується.
Сульфур (VI) оксид – безбарвна рідина, при 44,7 0С переходить у газ. При температурі нижче 17 0С кристалізується.
Хімічні властивості.
Оксиди сульфуру (IV) та (VI) – кислотні оксиди, виявляють усі характерні властивості класу.
1. Взаємодіють з основними оксидами з утворенням солей – сульфітів та сульфатів відповідно:
СаO + SO2 = СаSO3, K2O + SO3 = K2SO4.
2. Реагують з лугами з утворенням відповідних солей
Ba(OH)2 + SO2 = BaSO3 + 2H2O, NaOH + SO3 = Na2SO4 + H2O.
3. Взаємодіють з водою з утворенням відповідно сульфітної H2SO3 та сульфатної кислот H2SO4:
SO2 + H2O = H2SO3, SO3 + H2O = H2SO4.
H2SO3 – слабка кислота, H2SO4 – сильна кислота.
Середні солі сульфітної кислоти – сульфіти (натрій сульфіт Na2SO3, кальцій сульфіт CaSO3), кислі – гідрогенсульфіти (калій гідрогенсульфіт KHSO3, амоніак гідрогенсульфіт NH4HSO3).
Сульфіти вступають в окисно-відновні реакції, окиснюючись до сульфатів:
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O.
4. Сульфур (IV) оксид може виступати відновником у реакціях з окисниками:
2SO2 + O2 = 2SO3,
5SO2 + 2KMnO4 + 2H2O = 2H2SO4 + 2MnSO4 + K2SO4.
5. Менш характерними для сульфур (IV) оксиду є окисні властивості:
2H2S + SO2 = 2H2O + 3S.
6. Сульфур (VI) оксид – сильний окисник, відновляється до сульфур (IV) оксиду:
SO3 + 2HCl = Cl2 + SO2 + H2O
Використання.
Сульфур (IV) оксид використовують у виробництві сульфатної кислоти, для добування сульфур (VI) оксиду, відбілювання різних матеріалів, дезинфекції; обкурювання овочів у сховищах для запобігання їх псуванню.
Сульфур (VI) оксид використовують для добування сульфатної кислоти контактним способом.