35. Спирти
Спирти
Серед речовин, до складу яких, крім вуглецю та водню, входить також кисень, виділяють такі: спирти, феноли, альдегіди, кетони, кислоти, етери (прості ефіри), естери (складні ефіри) і вуглеводи.
Визначення. Спирти – це похідні вуглеводнів, у яких один або кілька атомів водню заміщені функціональною групою – гідроксигрупою –ОН. Загальна формула спиртів – R–(ОН)n, де R – вуглеводневий радикал.
Класифікація. Залежно від числа гідроксигруп спирти поділяють на одноатомні з загальною формулою R–ОН (n = 1) , двоатомні– R–(ОН)2 (n = 2) та багатоатомні – R–(ОН)n (n > 2).
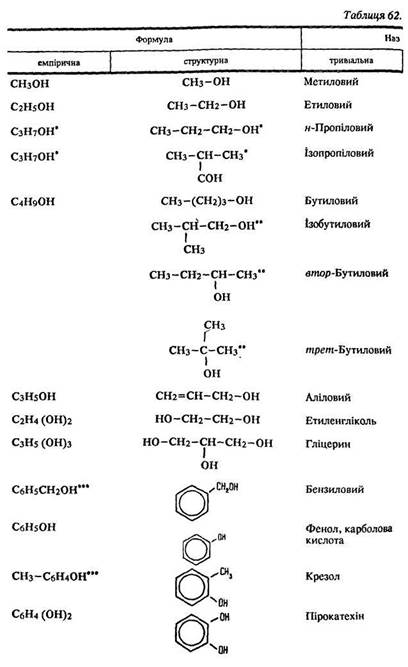
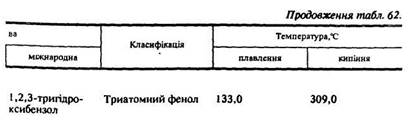
За характером вуглеводневого радикалу розрізняють аліфатичні спирти (насичені та ненасичені) і ароматичні (табл. 62).

Залежно від положення гідроксигрупи (ії розташування біля первинного, вторинного чи третинного вуглецевого атома) розрізняють такі спирти: первинні – з загальною формулою R–СН2–ОН; вторинні (вторспирти)
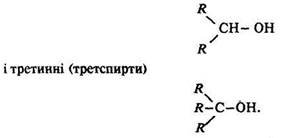
Первинним є вуглецевий атом, який зв’язаний з іншим атомом вуглецю однією валентністю СН3–СН3, вторинним – з’єднаний з двома атомами вуглецю двома валентностями СН3–СН2–СН3, третинним – зв’язаний з трьома атомами вуглецю трьома валентностями 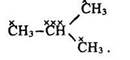
Номенклатура. Вживають такі тривіальні назви спиртів: метиловий, етиловий, гліцерин, бензиловий тощо (див. табл. 62).
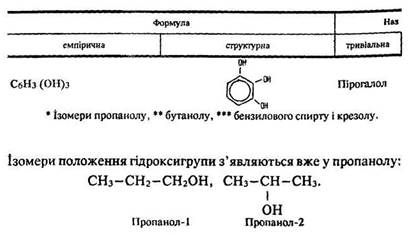
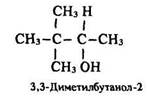
За міжнародною номенклатурою до назви відповідних вуглеводнів додається закінчення -ол, цифрою позначається положення гідроксигрупи – ОН, нумерація починається з кінця, до якого Ця група ближче:
Спирти утворюють гомологічні ряди, в яких кожний наступний член відрізняється від попереднього на гомологічну різницю –СН2–. Наприклад, одноатомні насичені спирти (алканоли) утворюють гомологічний ряд з загальною формулою СnH2n+1ОН. Його представниками є метанол СН3ОН, етанол С2Н5ОН, пропанол С3Н7ОН, бутанол С4Н9ОН та ін.
Одноатомні ненасичені спирти утворюють гомологічні ряди алкенолів і алкінолів. Алкеноли мають загальну формулу СnH2n–1ОН. Перший представник цього ряду – аліловий спирт СН2=СН–СН2ОН. Спиртів з формулою СН2=СН–ОН не існує внаслідок нестійкості комбінації гідроксигрупи з атомом вуглецю з подвійним зв’язком.
Двоатомні насичені спирти (алкандіоли) утворюють гомологічний ряд з загальною формулою СnH2n(ОН)2. Першим його представником є етиленгліколь, або етандіол-1,2 СН2ОН–СН2ОН.
Триатомні насичені спирти (алкантріоли) утворюють гомологічний ряд з загальною формулою СnH2n–1(ОН)3.
Перший його представник – гліцерин, або пропантріол-1,2,3 СН2ОН–СНОН–СН2ОН.
Ароматичні спирти – це гідроксипохідні ароматичних вуглеводнів, в яких гідроксигрупи зв’язані з атомами вуглецю бічного ланцюга. Вони утворюють гомологічний ряд з загальною формулою С6Н5–(СН2)n–СН2–OН. Перший представник цього ряду – бензиловий спирт С6Н5–СН2–ОН.
Ізомерія. У спиртів має місце структурна ізомерія (ланцюга та положення гідроксигрупи), міжкласова ізомерія.
Тому спирти мають більше ізомерів, ніж відповідні вуглеводні. Так, бутан існує у формі двох ізомерів (бутан та ізобутан), а бутанол – чотирьох (див. табл. 62). У алканолів с ізомери в іншому класі органічних сполук – етерах. Склад етилового спирту СН3–СН2ОН і диметилового етеру СН3–О–СН3 однаковий і описується однією емпіричною формулою С2Н6О. Проте ці речовини характеризуються неоднаковою будовою і виявляють, як відомо, зовсім різні властивості (п. 21.1). Ароматичні спирти мають ізомери серед фенолів, наприклад бензиловий спирт і крезол.
Будова молекули. Розглянемо будову одноатомних насичених спиртів на прикладі етанолу. Його емпіричній формулі С2Н5О відповідають дві структурні:
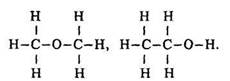
У речовині, будова якої описується першою формулою, всі атоми водню однакові за своїми властивостями. У речовині, будову якої відображає друга формула, один атом водню сполучений з атомом вуглецю через кисень. Цей атом водню за своїми властивостями відрізняється від інших п’яти.
Етиловий спирт, як і інші спирти, взаємодіє з металічним натрієм. Під час реакції із спирту кількістю речовини 1 моль виділяється водень, об’єм якого становить 11,2 л (за нормальних умов), кількість речовини – 0,5 моль та утворюється сіль – алкоголят натрію. Тобто з кожної молекули спирту виділяється один атом водню:
2С2Н5ОН + 2Nа = 2С2Н5ONа + Н2.
Ці факти свідчать, що друга формула є структурною формулою спирту, тобто в молекулі спиртів вуглеводневий радикал зв’язаний з гідроксигрупою. Електронна формула етанолу
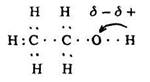
пояснює причину рухливості атома водню в гідроксильній групі. Всі зв’язки в молекулі спирту (вуглець–вуглець, вуглець–водень і вуглець–кисень–водень) є ковалентними сигма-зв’язками. На відміну від вуглеводнів молекули спиртів полярні внаслідок полярності зв’язку О–Н. Зв’язок О–Н поляризований, його електронна густина зміщена від атома водню до атома кисню – більш електронегативного елемента. Внаслідок цього атом водню гідроксигрупи може заміщуватися металом.
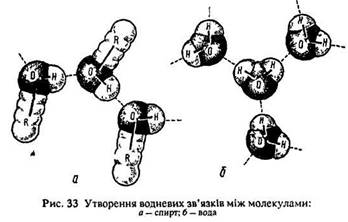
Чотири орбіталі зовнішнього енергетичного рівня атома кисню знаходяться в стані sp3-гібридизації. Дві з них, які містять неспарені електрони, утворюють сима-зв’язки з атомами вуглецю та водню, дві інших зайняті власними неподіленими електронними парами. Внаслідок їх відштовхування кут між зв’язками О–Н та О–С приблизно дорівнює куту між зв’язками – ОН у воді (104,5°), тобто трохи менший за тетраедричний (рис. 33). За рахунок цих же неподілених електронних пар утворюються водневі зв’язки між молекулами спиртів.
На відміну від вуглеводнів уже перші члени гомологічного ряду спиртів є рідинами (див. табл. 62). Під час розгляду фізичних властивостей вуглеводнів ми пояснювали зміну агрегатного стану в гомологічному ряду збільшенням їх молекулярних мас (п. 22.1). Проте відносна молекулярна маса метанолу СН3ОН (Мr = 32), який є рідиною, менша ніж газоподібного пропану С3Н8 (Мr = 44), але протиріччя тут немає.
«Легкі» молекули спиртів утворюють асоціати за рахунок водневих зв’язків і тому утримуються в рідкому стані (див. рис. 33). Виникненням водневих зв’язків між молекулами спирту та води пояснюється також розчинність спиртів у воді. Вуглеводні не утворюють з водою водневих зв’язків і тому не розчиняються в ній. Зменшення розчинності в гомологічному ряду спиртів обумовлене збільшенням їх вуглеводневого радикалу.
Поширення в природі. Спирти у вільному стані трапляються в рослинах (продукт бродіння глюкози) або в тваринних організмах (продукт метаболізму – етанол). У зв’язаному стані вони у вигляді ефірів входять до складу рослинних ефірних масел, восків, рослинних та тваринних жирів.
Фізичні властивості. Спирти, в молекулах яких міститься до 15 атомів вуглецю, – рідини, інші – тверді речовини. Всі вони легші за воду. Метанол, етанол та пропанол змішуються з водою в будь-яких співвідношеннях. Зі зростанням молекулярної маси розчинність спиртів у воді знижується. Вищі спирти практично не розчиняються у воді. Температури плавлення та кипіння і розчинність спиртів вищі, ніж вуглеводнів.
Хімічні властивості.
Реакції за участю гідроксигруп. Ці реакції можна поділити на дві групи: такі, що відбуваються з розривом зв’язку О–Н і з розривом зв’язку С–О.
1. Реакції, які відбуваються з розривом зв’язку О–Н. Спирти виявляють слабкі кислотні властивості, що слабшають із подовженням аліфатичного радикалу. Як відомо, аліфатичні вуглеводневі радикали мають позитивний індукційний ефект щодо атома водню, індукційний ефект якого приймається за нуль. Зі збільшенням довжини радикалу внаслідок посилення цього ефекту зменшується полярність зв’язку О–Н. Метанол має найсильніші кислотні властивості в ряду алканолів. Його ступінь дисоціації дуже малий (3х10–6%), тому водні розчини метанолу не змінюють колір індикаторів і в них не виявляються іони водню.
Алкоголяти – тверді речовини. Як солі слабких кислот вони гідролізуються у розчині, створюючи лужне середовище:
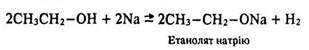
Взаємодія з металами. Спирти активно реагують з лужними металами, менш активно – з лужноземельними, магнієм і алюмінієм. Ці реакції належать до реакцій заміщення – виділяється водень і утворюються солі – алкоголяти (метаноляти, етаноляти, пропаноляти тощо):
![]()
Ця реакція є оборотною.
Взаємодія з лугами. Спирти за звичайних умов з лугами не взаємодіють, оскільки алкоголяти повністю гідролізуються. Проте підвищення температури і видалення води зміщує хімічну рівновагу в бік утворення алкоголяту:
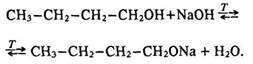
Взаємодія з кислотами. Спирти взаємодіють з органічними та мінеральними кисневмісними кислотами з утворенням естерів. Ці реакції називаються реакціями етерифікації. їх назва походить від слова ether, що означає ефір.
Під час взаємодії спиртів з органічними та мінеральними кисневмісними кислотами за наявності водопоглинальних засобів утворюються естери:
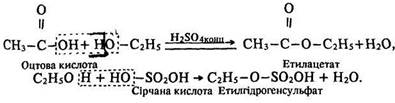
Внаслідок взаємодії надлишку спирту з сірчаною кислотою за температури 250 °С відбувається дегідратація спирту і утворюється диетиловий етер. Реакція протікає в дві стадії (порівняйте з попередньою реакцією):
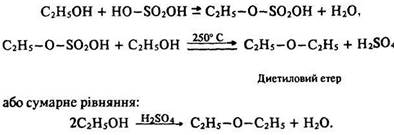
2.Реакції, що відбуваються з розривом зв’язку С–О. Під час пропускання сухого бромоводню крізь гарячий спирт за наявності речовини, що забирає воду, відбувається заміщення гідроксигрупи з утворенням алкілгалогеніду.
За рахунок негативного індукційного ефекту гідроксигрупи зв’язок С–О є поляризованим: СН3–СН2–>ОН. Взаємодія з полярною молекулою бромоводню Н–Вr відбувається за такою схемою:
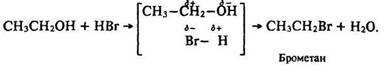
Реакції за участю гідроксигруп та вуглеводневих радикалів. Реакція дегідратації. Під час нагрівання спирту з концентрованою сірчаною кислотою до температури 350 °С (порівняйте з реакцією добування простих ефірів за Т = 250 °С) реакція дегідратації відбувається за іншим механізмом: відщеплюються водень вуглеводневого радикалу і гідроксигрупа, утворюється ненасичений вуглеводень – алкен; за 500 °С– алкадієн:
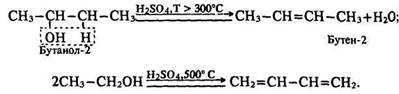
За правилом Зайцева водень відщеплюється від менш гідрогенізованого атома вуглецю, що стоїть у ланцюгу поруч з атомом вуглецю, зв’язаним з гідроксигрупою. Таким чином, залежно від умов реакція дегідратації спиртів відбувається за різними механізмами з утворенням різних продуктів: за нижчих температур – етерів, за вищих – ненасичених вуглеводнів. Це явище використовують у промисловості – пропускаючи пару етанолу над каталізатором Аl2О3 (Т = 250 °С), добувають діетиловий ефір, а за температури 350° С– етилен, 500 °С – бутадієн. Окислення. Якщо спирт підпалити, він горить:
![]()
Під дією інших окисників (Н2СrO4, К2Сr2O7 + Н2SO4, КМnO4, Сu) утворюються альдегіди та кетони – спочатку окислюється атом вуглецю, зв’язаний з гідроксигрупою, а потім відщеплюється вода. В результаті окислення первинних спиртів утворюються альдегіди, вторинних – кетони:
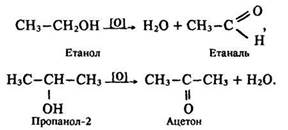
Під час нагрівання з металічною міддю відбувається реакція дегідрування:
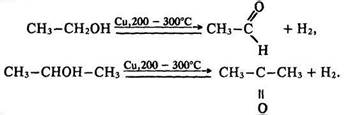
Альдегіди легко окислюються до кислот, тому за реакцією окислення первинних спиртів одержують відповідні кислоти:
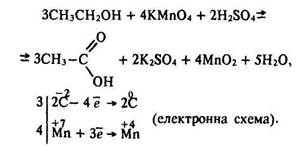
Ступінь окислення вуглецю розраховують за брутто-формулою етанолу С2Н6О та оцтової кислоти С2Н4О2.
Ароматичні спирти мають такі ж хімічні властивості, як аліфатичні.
Одержання та застосування спиртів розглянуто на прикладі метанолу, етанолу, етиленгліколю, гліцерину.