16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
16.2. Галогеноводні та галогеніди.
Галогени утворюють з Гідрогеном сполуки типу H–Hal, водні розчини яких є кислотами.
У галогеноводнях зв`язок – ковалентний полярний. У цих сполуках галогени виявляють найнижчий ступінь окиснення –1.
Одержання галогеноводнів.
- Взаємодія простих речовин H2 і Hal2:
H2 + Hal2 = 2HHal.
2. Дією концентрованої сульфатної кислоти на тверді солі галогеноводневих кислот:
CaF2 + H2SO4 = CaSO4 + 2 HF, NaCl + H2SO4 = NaHSO4 + 2HCl.
Одержати HBr і HI цим методом неможливо:
2KBr + 3H2SO4 = Br2 + 2KHSO4 + 2H2O + SO2,
8KI + 9H2SO4 = 4I2 + 8KHSO4 + 4H2O + H2S.
Фізичні властивості.
За н. у. HF – рідина, решта галогеноводнів – безбарвні гази. Висока температура кипіння HF пояснюється утворенням водневих зв`язків.
H–F∙∙∙H–F∙∙∙H–F
Усі галогеноводні добре розчинні у воді. Так 1 об`єм води розчиняє 500 об`ємів HCl. Розчин HF у воді – фторидна (плавикова) кислота, розчин HCl у воді – хлоридна (соляна) кислота.
Хімічні властивості.
Сила кислот у ряду HF – HCl – HBr – HI зростає. HF – кислота середньої сили, усі інші – сильні.
HF реагує зі склом за схемою:
40HF + CaO∙Na2O∙6SiO2 = CaF2 + 2NaF + 6H2[SiF6] + 14H2O,
тому плавикову кислоту зберігають у тефлонових балонах.
Реакція розчинення скла у HF лежить в основі процесу травлення – нанесення написів та візерунків на скляні вироби.
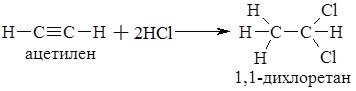
Газоподібний HCl реагує з амоніаком NH3, лугами, органічними речовинами (реакції приєднання):
NH3 + HCl = NH4Cl (або NH3∙HCl, [NH4+]Cl–),
NaOH+ HCl = NaCl + H2O
Хлоридна кислота – безбарвна рідина з різким запахом. Масова частка HCl – 37%.
Хлоридна кислота виявляє усі характерні властивості кислот: реагує з металами, оксидами, основами і деякими солями, з утворенням хлоридів.
Fe + 2HCl = FeCl2 + H2, CaO + 2HCl = CaCl2 + H2O,
Al(OH)3 + 3HCl = AlCl3 + H2O, NaHCO3+ HCl = NaCl + H2O + CO2.
При взаємодії HCl із сильними окисниками (KMnO4, K2Cr2O7, MnO2, PbO2) утворюється газоподібний Cl2:
14HCl + K2Cr2O7 = 3Cl2 + 2KCl + 2CrCl3 + 7H2O,
що застосовують для добування Cl2 у лабораторії.
Хлоридна кислота входить до складу шлункового соку і підтримує його pH ≈ 1,2. Її використовують для добування хлоридів, травлення металів при паянні та у гальванопластиці.
Солі галогеноводневих кислот – галогеніди (фториди, хлориди, броміди, йодиди). Більшість галогенідів добре розчинні у воді.
Галогеніди (крім фторидів) виявляють відновні властивості:
6NaI + K2Cr2O7 + 7H2SO4 = 3I2 + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O.
Якісні реакції на галогенід-іони.
Якісними називають реакції, якими можна виявити у досліджуваному розчині дану речовину. Якісними реакціями на галогенід-іони є взаємодія з аргентум нітратом AgNO3, у результаті якої утворюються малорозчинні солі:
Ag+ + Cl– = AgCl↓, Ag+ + Br– = AgBr↓, Ag+ + I– = AgI↓.
Вони утворюють осади характерного вигляду і забарвлення: AgCl – білий сирнистий, AgBr – світло-жовтий дрібнокристалічний, AgI – жовтий.
Усі галогеніди аргентуму нерозчинні у нітратній кислоті, але розчинні в амоніаку:
AgCl + NH3 = [Ag(NH3)2]Cl
При підкисленні нітратною кислотою відбувається зворотний процес:
[Ag(NH3)2]Cl + 2HNO3 = AgCl¯ + 2NH4NO3.
Застосування галогенідів.
Натрій хлорид використовують як харчову приправу, у виробництві хлору, хлороводню, мила. Калій хлорид – калійне добриво. Кальцій хлорид – осушуючий реагент і компонент охолоджуючих сумішей (суміш CaCl2 і льоду у відношенні 1:1,43, знижує температуру до –55 0С).
Броміди і йодиди використовують у фотографії як світлочутливі реагенти та у виробництві лікарських засобів.