18. ЕЛЕМЕНТИ VА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18. ЕЛЕМЕНТИ VА ПІДГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18.7. Оксигеновмісні сполуки фосфору
Фосфор з Оксигеном утворює оксиди фосфору (III) та (V).
Фосфор (III) оксид (фосфористий ангідрид). Йому відповідає формула P4O6 (рис. 18.3).
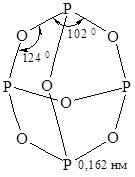
Рис. 18.3. Молекула Р4О6.
Утворюється при горінні фосфору за нестачі кисню. P4O6 – біла кристалічна речовина. Реакція його з водою веде до утворення фосфористої кислоти:
P4О6 + 6H2O = 4H3PO3.
Оксид фосфору (III), фосфориста кислота та її солі – фосфіти – сильні відновники.
Фосфор (V) оксид (фосфатний ангідрид). Йому відповідає формула P4O10 (рис. 18.4).
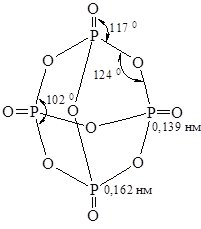
Рис. 18.4. Молекула Р4О10.
Утворюється при горінні фосфору в надлишку кисню. P4O10 – білий гігроскопічний порошок. Типовий кислотний оксид. При взаємодії з водою, залежно від умов, утворюються різні кислоти фосфору. На холоді утворюється тетраметафосфатна кислота :
P4О10 + 2H2O = (HPO3)4.
З більшою кількістю води утворюється дифосфатна (пірофосфатна) кислота:
P4О10 + 4H2O = 2H2P4O7.
При надлишку води утворюється фосфатна кислота:
P4О10 + 6H2O = 4H3PO4.
Кип`ятіння (HPO3)4 та H2P4O7 з надлишком води веде до утворення фосфатної кислоти:
(HPO3)4 + 4H2O = 4H3PO4, H2P4O7 + H2O = 4H3PO4.
Аналогічно, з лугами Р4О10 утворює солі – мета- або ортофосфати:
Р4О10 + 4NaOH = 4NaPO3 + 2H2O Р4О10 + 12NaOH = 4Na3PO3 + 6H2O
натрій метафосфат натрій ортофосфат
Р4О10 енергійно віднімає воду від кислот, що дає можливість одержувати ангідриди відповідних кислот:
Р4О10 + 4HNO3 = 4HPO3 + 2N2O5, Р4О10 + 4HClO4 = 4HPO3 + 2Cl2O7.
При сплавленні Р4О10 з карбонатами або гідрогенкарбонатами лужних і лужноземельних металів утворюються метафосфати:
4NaHCO3 + P4O10 = 4NaPO3 + 4CO2 + 2H2O.
Найважливішою з кислот фосфору є ортофосфорна кислота H3PO4 зі ступенем окислення Фосфору +5.
Одержують H3PO4 у лабораторії взаємодією фосфору з 30% нітратною кислотою:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
У промисловості H3PO4 – дією концентрованої сульфатної кислоти на фосфорит Ca3(PO4)2:
Ca3(PO4)2 + 2H2SO4 = H3PO4 + СaSO4↓,
або спалюванням фосфору з надлишком кисню і наступним розчиненням P4O10 у надлишку води. Останній метод дозволяє одержати дуже чисту концентровану фосфатну кислоту.
Фізичні властивості. Безводна H3PO4 – безбарвні прозорі кристали з т. пл. 42 0С. Дуже добре розчинна у воді, нелетка.
Хімічні властивості. У водному розчині H3PO4 – кислота середньої сили. Дисоціює ступінчато:
І ступінь: H3PO4 ↔ H2PO4– + H+,
ІІ ступінь: H2PO4– ↔ HPO42–+ H+,
ІІІ ступінь: HPO42– ↔ PO43–+ H+.
H3PO4 виявляє усі властивості, характерні для кислот-неокисників. Реагує з активними металами, основними оксидами, солями слабких кислот (карбонатами, силікатами) з утворенням солей – фосфатів (ортофосфатів). H3PO4, як триосновна кислота утворює три типи солей: середні і кислі з одним або двома атомами гідрогену у складі кислотного залишку:
K3PO4, Ca3(PO4)2 – середні солі – ортофосфати,
K2HPO4, CaHPO4 – дизаміщені кислі солі – моногідрогенфосфати,
KH2PO4, Ca(H2PO4) – монозаміщені кислі солі – дигідрогенфосфати.
Дигідрогенфосфати розчинні у воді, із моногідрогенфосфатів та ортофосфатів у воді розчинні лише солі лужних металів і амоніаку.
У водних розчинах середніх і дизаміщених фосфатів лужних металів рН > 7, у монозаміщених – рН < 7 (табл 18.2).
Таблиця 18.2
рН 1% розчинів натрій фосфатів
|
Сіль |
рН |
|
Na3PO4 |
12,1 |
|
Na2HPO4 |
8,9 |
|
NaH2PO4 |
6,4 |
Ортофосфати одержують дією надлишку лугу на фосфатну кислоту:
H3PO4 + 3NaOH = Na3PO4 + 3H2O,
або дією лугу на кислі фосфати:
Na2HPO4 + NaOH = Na3PO4 + H2O, NaH2PO4 + 2NaOH = Na3PO4 + 2H2O.
Моногідрогенфосфати утворюються при взаємодії лугу з фосфатною кислотою у відношенні 2 : 1:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O,
при дії лугу на NaH2PO4 або NaH2PO4:
NaH2PO4 + NaOH= Na2HPO4 + H2O,
при дії фосфатної кислоти на Na3PO4:
2Na3PO4 + H3PO4 = 3Na2HPO4.
або взаємодією NaH2PO4 та Na3PO4:
NaH2PO4 + Na3PO4 = 2Na2HPO4.
Дигідрогенфосфати утворюються при взаємодії лугу з фосфатною кислотою у співвідношенні 1:1:
NaOН + H3PO4 = 3NaН3PO4 + Н2О,
або при дії фосфатної кислоти на Na3PO4 чи Na2HPO4:
2H3PO4 + Na3PO4 = 3NaH2PO4, H3PO4 + Na2HPO4 = 2NaH2PO4.
Під дією сильних кислот нерозчинні фосфати переходять у розчинні форми:
Ca3(PO4)2 + 4HNO3 = 2Ca(H2PO4)2 + 2Ca(NO3)2.
Якісною реакцією на фосфати є взаємодія з AgNO3 з утворенням яскраво-жовтого осаду Ag3РO4, розчинного у кислотах:
PO43– + 3Ag+ = Ag3РO4↓,
HPO42– + 3Ag+ = Ag3РO4↓ + H+,
H2PO4– + 3Ag+ = Ag3РO4↓ + 2H+.
Застосування оксигеновмісних сполук фосфору.
Оксид Р4О10 застосовують у хімічних лабораторіях для осушення речовин кислої природи (SO3, SO2, CO2, CH3COOH тощо).
Фосфатну кислоту використовують при виготовленні мінеральних добрив і миючих засобів.