16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
16. ЕЛЕМЕНТИ VIIA ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛОГЕНІВ
16.1. Хлор
Електронна структура.
Хлор – елемент 3 періоду VIIА групи. Заряд ядра + 17, будова зовнішнього електронного рівня 3s23p5. Приймаючи один електрон, хлор набуває електронної конфігурації аргону. Має високі електронегативність (3,0) і спорідненість до електрона.
Молекула Cl2 складається із двох атомів Хлору зв`язаних ковалентним неполярним зв`язком. Довжина зв`язку 0,198 нм, енергія – 243 кДж/моль.
Перехід атома у збуджений стан супроводжується розпаровуванням електронів 3p- і 3s-підрівнів та переходом їх на вільні орбіталі близького за енергією 3d-підрівня:
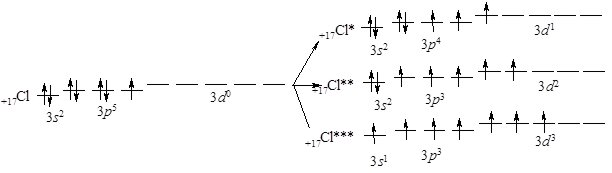
Внаслідок цього кількість неспарених електронів зростає від 1 (у незбудженого атома) до 3, 5 або 7, що дає змогу виявляти ступені окиснення + 1, + 3, + 5, + 7, а також + 4 і + 6 (див. Оксигеновмісні сполуки Хлору).
Поширення у природі.
Масова частка хлору в земній корі становить 0,045%. У вільному стані хлор не зустрічається, найчастіше існує у формі хлоридів. Мінерали: NaCl – галіт, KCl – сильвін, KCl∙NaCl сильвініт, KCl∙MgCl2∙6H2O – карналіт. Багато хлоридів міститься у морській воді.
Природні ізотопи: ![]() і
і ![]() (75,4% і 24,6% відповідно).
(75,4% і 24,6% відповідно).
Одержання в лабораторії.
1. Окисненням хлоридної кислоти або хлоридів у кислому середовищі:
2KMnO4 + 16HCl = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
PbO2 + 2NaCl + 4H2SO4 = Cl2 + Pb(HSO4)2 + 2NaHSO4 + 2H2O
Як окисники використовують KMnO4, K2Cr2O7, KClO3, PbO2.
2. Взаємодією HCl з хлорним вапном:
4HCl + Ca(OCl)Cl = CaCl2 + Cl2 + 2H2O
3. Методом Велдона:
MnO2 + 4HCl = MnCl2+ Cl2 + 2H2O
Одержання в промисловості.
- Електролізом розплавів або водних розчинів хлоридів:
2NaClрозпл. ![]() 2Na + Cl2,
2Na + Cl2,
2NaCl + 2H2O = 2NaOH + Cl2 + H2.
Хлор утворюється на аноді.
- Електролізом HCl:
2HCl = Cl2 + H2,
хлор утворюється на аноді.
- Методом Дікона за наявності CuCl2:
4HCl + O2 = 2Cl2 + 2H2O.
Фізичні властивості.
За н. у. хлор – жовто-зелений газ з різким запахом, важчий за повітря. Розчиняється у воді, взаємодіючи з нею.
Отруйний, викликає подразнення органів дихання, у високій концентрації – задуху і смерть. Температура плавлення –101,0 0С, температура кипіння –34,1 0С.
Хімічні властивості.
Зв`язок у молекулі Cl2 легко руйнується при дії УФ-світла (сонячні промені), що веде до утворення частинок з неспареними електронами і високою хімічною активністю – радикалів:
Cl2 ![]() 2Cl·.
2Cl·.
1. Хлор легко реагує практично з усіма металами (навіть із золотом) окиснюючи їх до найвищого ступеня окиснення і утворюючи солі – хлориди:
2Na + Cl2 = 2NaCl, 2Fe + 3Cl2 = 2FeCl3, Cu + Cl2 = CuCl2,
2.Реагує з більшістю неметалів (крім O2, N2, C):
Cl2 + H2= 2HCl, 5Cl2 + 2P = 2PCl5, 3Cl2 + P = PCl3.
Сполуки Хлору з неметалами (крім Гідрогену) називають галогенангідридами відповідних кислот.
3. З водою:
Cl2 + H2O ↔ HCl + HClO.
Розчин хлору у воді називають хлорною водою.
4. З водними розчинами лугів:
а) за н. у.: Cl2 +NaOH = NaCl + NaClO + H2O,
б) при 1000С: 3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O.
5. Взаємодія з галогенідами. Хлор витісняє інші галогени (крім Флуору) з їх солей у розплавах і водних розчинах:
Cl2 +KBr = KCl + Br2, Cl2 +KI = KCl + I2.
Ці реакції використовують для одержання Br2 і I2 в промисловості.
6. Окиснення інших речовин. Хлор окиснює інші галогени (крім F2):
Br2 + 5Cl2 + 12KOH = 2KBrO3 + 10KCl + 6H2O.
Реагує з типовими відновниками:
Cl2 + SO2 + 2H2O = H2SO4 + 2HCl.
7. З органічними речовинами хлор вступає у реакції приєднання та заміщення (див. Органічна хімія).
Застосування галогенів.
Фтор використовують для одержання тефлону (політетрафторетилену, фторопласту) стійкого до дії агресивних реагентів і високих (до 3000С) температур, який застосовують у виробництві хімічної апаратури. Сполуки фтору використовують у медицині (компоненти зубних паст). В холодильних установках використовують фреони (фреон-12 CF2Cl2) – холодоагенти.
Хлор використовують для промислового одержання HCl, синтезу хлороорганічних сполук (пестицидів, розчинників, лікарських засобів) та дезинфекції води.
Розчин йоду (0,5% у спирті) застосовують для дезинфекції ран.