18. ЕЛЕМЕНТИ VА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18. ЕЛЕМЕНТИ VА ПІДГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18.1. Нітроген. Азот
Нітроген (лат. nitrogen – утворює селітру) – перший елемент VА групи Періодичної системи. На зовнішньому електронному рівні містить 5 електронів – 2s22p3:
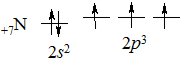
Завдяки наявності трьох неспарених р-електронів, атом Нітрогену може утворювати три ковалентні хімічні зв’язки за обмінним механізмом і ще один – за донорно-акцепторним, за рахунок неподіленої пари 2s-електронів. Тому максимальна валентність Нітрогену дорівнює 4. Ступені окиснення Нітрогену змінюються від –3 (приймає 3 електрони) до +5 (віддає 5 електронів).
Проста речовина – азот (гр. безжиттєвий) – двоатомний газ N2, атоми у молекулі якого сполучені трьома ковалентними неполярними зв’язками: N≡N. Завдяки такому зв’язку молекула азоту міцна і хімічно інертна. Механізм утворення ковалентного зв’язку у молекулі азоту розглянуто в розд. Ковалентний зв’язок.
Поширення у природі.
Основна маса азоту зосереджена в атмосферному повітрі (78% за об’ємом). У великій кількості зв’язаний азот міститься в чилійській селітрі NaNO3.
Зв’язаний азот міститься в усіх живих організмах у складі білків та нуклеїнових кислот.
Загальний вміст азоту в земній корі (включаючи атмосферу і гідросферу) становить 0,04% за масою.
Одержання.
У лабораторії азот одержують нагріванням амоній нітриту NH4NO2:
NH4NO2 = N2 + 2H2O,
або дією газоподібного амоніаку NH3 на розпечений CuO:
3CuO + 2NH3 = N2 + Cu + 3H2O.
У промисловості азот одержують з повітря шляхом глибокого охолодження і наступною фракційною перегонкою.
Фізичні властивості.
За н. у. азот – безбарвний газ без запаху і смаку, легший за повітря. При –195,8 0С зріджується. Малорозчинний у воді (при 20 0С у 100 г води розчиняється 15,4 мл азоту).
Хімічні властивості.
1. За звичайних умов азот реагує з літієм, а при нагріванні і з іншими металами, утворюючи нітриди:
6Li + N2 = 2Li3N, 3Mg + N2 = Mg3N2.
Нітриди – солеподібні сполуки, які можна розглядати як продукти повного заміщення атомів Гідрогену у молекулі амоніаку на атоми металу. При дії води нітриди розкладаються на гідроксид відповідного металу та амоніак:
AlN + 3H2O = Al(OH3)¯ + NH3.
2. При високій температурі і тиску азот сполучається з воднем з утворенням амоніаку:
N2 + 3H2 = 2NH3.
3. При температурі вищій 3000 0С або під дією електричного розряду азот реагує з киснем з утворенням NO:
N2 + O2 ↔ 2NO,
який на повітрі окиснюється до NO2:
2NO + O2 ↔ NO2.
Застосування.
Основну масу азоту використовують у промисловості для синтезу амоніаку за процесом Габера (див. Амоніак).
Азотом заповнюють електролампи, використовують для створення інертної атмосфери при зварювальних роботах. Рідкий азот використовують у холодильних установках для одержання низьких температур.