18. ЕЛЕМЕНТИ VА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18. ЕЛЕМЕНТИ VА ПІДГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18.2. Амоніак. Солі амоніаку
Найважливішою сполукою Нітрогену з Гідрогеном є амоніак NH3. Молекула амоніаку – пірамідальна, полярна (рис. 14.1). Ступінь окиснення атома Нітрогену –3. Атомні орбіталі Нітрогену перебувають у стані sp3-гібридізації і утворюють три s-зв’язки з трьома атомами Гідрогену. Молекула амоніаку – яскраво виражений донор електронної пари, що дає можливість утворювати хімічні зв’язки за донорно-акцепторним механізмом.
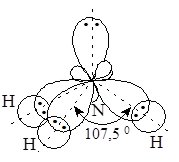
Рис. 14. 1. Молекула амоніаку.
Одержання.
У лабораторії амоніак одержують шляхом нагрівання хлориду амонію NH4Cl з гашеним вапном Ca(OH)2:
NH4Cl + Ca(OH)2 = 2NH3+ CaCl2 + 2H2O.
У промисловості раніше амоніак одержували ціаноамідним способом у дві стадії. На першій стадії проводили реакцію N2 з кальцій карбідом CaC2 при нагріванні:
CaC2 + N2 = CaCN2 + C.
Далі дією води на утворений продукт одержували амоніак:
CaCN2 + 3H2O = CaCO3 + 2NH3.
Сьогодні амоніак одержують виключно безпосередньою взаємодією простих речовин H2 і N2 при високій (5000С) температурі і тиску (30 мПа) за наявності каталізатора Fe/Al2O3:
N2 + 3H2 ↔ 2NH3, ΔH = –92 кДж.
Рівновага реакції зміщена ліворуч, тому з реакційної суміші при охолодженні виділяють амоніак, а азот і водень, що не прореагували вводять у наступний цикл. Описану технологію вперше застосував у 1908 р. Ф. Габер (Німеччина), тому її називають процес Габера.
Фізичні властивості.
За н. у. амоніак – безбарвний газ з різким запахом, легший за повітря. При –33,4 0С зріджується, а при –77,8 0С кристалізується.
Висока температура кипіння газоподібного амоніаку зумовлена утворенням міжмолекулярних водневих зв’язків.
Амоніак дуже добре розчинний у воді: в 1 об’ємі води розчиняється 700 об’ємів амоніаку. Максимальна масова частка амоніаку у воді – 25%. Такий розчин амоніаку називають аміачною водою, 10% розчин – нашатирний спирт. Зі зростанням температури розчинність амоніаку зменшується і він виділяється з розчинів.
Хімічні властивості.
1. Горить у кисні зеленим полум’ям:
4NH3 + 3O2 = 2N2 + 6H2O.
2. За наявності каталізаторів (Pt, Fe2O3) горить з утворенням NO:
4NH3 + 5O2 = 4NO + 6H2O.
Цю реакцію використовують у виробництві нітратної кислоти.
3. Реагує з окисниками:
2NH3 + 3CuO = N2 + 3Cu + 3H2O, 2NH3 + 3Br2 = N2 + 6HBr.
4. При пропусканні над розплавленими активними металами утворює аміди:
2NH3 + 2Na = 2NaNH2 + H2,
які при дії води розкладаються на луг і амоніак:
NaNH2 + H2O = NaOH + NH3.
5. При нагріванні амоніак знебарвлює розчини перманганатів:
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O.
6. Основні властивості виявляє за рахунок утворення водневих зв’язків з молекулами води і встановленням рівноваги:
NH3 + H2O ↔ NH3∙H2O ↔ NH4+ + OH–.
Розчин амоніаку у воді – електроліт зі слабкими основними властивостями. Оскільки концентрація іонів ОН– у розчині дуже незначна, то говорити про існування іонної сполуки NH4OH не можна.
Комплексний іон NH4+ тетраедричної будови утворюється за донорно-акцепторним механізмом, усі зв’язки N—Н у ньому рівноцінні:
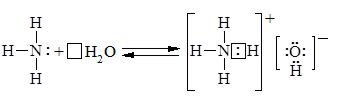
Аналогічно амоніак реагує з кислотами, утворюючи солі амоніаку:
NH3 +HCl = NH4Cl, 2NH3 + H2SO4 = (NH4)2SO4.
У цих реакціях амоніак є основою Льюїса (акцептором протона).
- За схожим механізмом відбувається утворення комплексних сполук – амоніакатів:
AgCl + 2NH3 = [Ag(NH3)2]Cl.
8. Аналогічно амоніак реагує з галогенопохідними вуглеводнів з утворенням солей алкіламоніаку – реакція Гофмана (див. Органічна хімія):
СН3І + 2NH3 = [СН3N+H3]І–.
Солі амоніаку.
Солі амоніаку – іонні сполуки, легко розчинні у воді.
1. У воді солі амоніаку гідролізують, створюючи кисле середовище (рН < 7):
NH4Cl + H2O ↔ NH3 + H2O + HCl.
2. Виявляють усі характерні властивості солей. У реакціях обміну іон NH4+ зберігається:
NH4Cl + AgNO3 = NH4NO3+ AgCl↓.
3. При дії лугів утворюються амоніак і вода:
NH4NO3 + NaOH = NH3 + H2O + NaNO3.
Це – якісна реакція на іон NH4+. Якщо при нагріванні речовини з лугом відчувається запах амоніаку, а вологий індикаторний папірець, піднесений до отвору пробірки синіє – це вказує на наявність іона NH4+ у складі речовини.
4. Солі амоніаку – термічно нестійкі, їх розклад може відбуватись оборотно або необоротно.
Оборотно розкладаються солі амоніаку, утворені аніонами кислот-неокисників:
NH4Cl ↔ NH3 + HCl, (NH4)2SO4 ↔ NH3 + NH4HSO4,
(NH4)2CO3 ↔ 2NH3 + CO2 + H2O, NH4HCO3 ↔ NH3 + CO2 + H2O.
Необоротно розкладаються солі амоніаку, утворенні аніонами кислот-окисників:
(NH4)2NO2 = N2 + 2H2O, NH4NO3 = N2O+ 2H2O,
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O.
Остання реакція супроводжується виділенням великої кількості тепла і світла, розбризкуванням іскор та утворенням зеленого попелу Cr2O3, тому називається “вулкан”.