18. ЕЛЕМЕНТИ VА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18. ЕЛЕМЕНТИ VА ПІДГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18.5. Нітратна кислота. Нітрати
Атом Нітрогену в нітратній кислоті виявляє максимальну валентність –4. Ступінь окиснення Нітрогену +5, він перебуває у стані sp2-гібридізації. Графічно молекула нітратної кислоти зображується у вигляді двох резонансних структур:
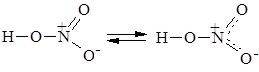
Одержання.
В лабораторії HNO3 одержують дією концентрованої сульфатної кислоти на тверді нітрати лужних або лужноземельних металів:
NaNO3 + H2SO4 = HNO3 + NaHSO4,
з наступною відгонкою HNO3 з реакційної суміші.
У промисловості добування HNO3 ведуть за процесом Оствальда, який складається із стадій:
1. окиснення амоніаку киснем повітря у присутності каталізатора Pt/Rh при 900 0С:
3NH3 + 5O2 = 4NO + 6H2O, ΔH = – 906 кДж/моль,
реакція екзотермічна, що дозволяє підтримувати температуру 900 0С без додаткового нагрівання;
2. окиснення NO до NO2 киснем повітря при охолодженні:
2NO + O2 = 2NO2;
3. поглинання NO2 водою в присутності кисню:
4NO2 + O2 + 2H2O = 4HNO3.
Утворюється розчин з масовою часткою НNO3 60%, який перегонкою концентрують до масової частки НNO3 68%, одержуючи при цьому азеотропну суміш*.
Подальше концентрування (до 98%) проводять перегонкою з сульфатною кислотою або P2O5.
Концентровану НNO3 перевозять в алюмінієвих цистернах, розбавлену – у посуді з кислотостійких матеріалів.
Фізичні властивості.
Чиста НNO3 – безбарвна рідина, густина 1,51 г/см3, кристалізується при ‑42 0С у прозору кристалічну масу. Температура кипіння 86 0С.
На повітрі димить, з водою змішується у будь-яких відношеннях. Технічна НNO3 забарвлена в жовтий колір за рахунок розчиненого у ній NO2.
Хімічні властивості.
І. Кислотні властивості. У водному розчині НNO3 практично повністю дисоціює на іони:
HNO3 + H2O = H3O+ + NO3–,
і є однією з найсильніших кислот. Виявляє усі характерні властивості кислот (реагує з оксидами, основами, солями) з утворенням солей – нітратів.
ІІ. При нагріванні на світлі частково розкладається:
4HNO3 = 4NO2 + O2 + 2H2O,
ІІІ. Окисні властивості.
Безводна НNO3 та у водних розчинах (розбавлених і концентрованих) виявляє сильні окисні властивості.
1. Взаємодія з неметалами:
а) концентрована НNO3 окиснює неметали до вищого ступеня окиснення, відновлюючись до NO2:
S + 6HNO3 = 6NO2 + H2SO4 + H2O, C + 4HNO3 = 4NO2 + CO2 + 2H2O,
P + 5HNO3 = 5NO2 + H3PO4 + H2O, I2 + 10HNO3 = 10NO2 + 2HIO3 + 4H2O.
б) розбавлена НNO3 відновлюється до NO, неметали окиснює до вищого ступеня окиснення:
S + 2HNO3 = 2NO + H2SO4, C + 4HNO3 = 4NO + 3CO2 + 2H2O,
3P + 5HNO3 + 2H2O = 5NO + 3H3PO4.
2. Взаємодія з металами.
а) Концентрована НNO3 при взаємодії з активними метали (лужними і лужноземельними) відновлюється до N2O:
4Mg + 10HNO3 = N2O + 4Mg(NO3)2+ 5H2O.
У реакції з металами середньої активності (Zn, Cd, Sn, Pb, Cu, Ag, Hg) НNO3 відновлюється до NO2:
Cu + 4HNO3 = NO2 + Cu(NO3)2+ 2H2O.
Концентрована НNO3 не реагує з Au, Pt і платиновими металами, а також не діє на Cr, Fe та Al внаслідок їх пасивації.
б) Розбавлена НNO3 при дії на метали (лужні та лужноземельні) відновлюється до NH4NO3:
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O.
Менш активні метали (Fe, Co, Ni, Sn) відновлюють розбавлену HNO3 до N2O:
8Fe + 30HNO3 = 8Fe(NO3)3 + 3N2O + 15H2O.
При дії розбавленої HNO3 на Pb, Cu, Bi виділяється NO:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Розбавлена HNO3 на Ag, Hg, Au і платинові метали не діє.
Слід зазначити, що у реакціях HNO3 з металами не виділяється водень, а утворюється суміш продуктів відновлення HNO3, співвідношення яких залежить від концентрації HNO3, активності металу, температури тощо.
Отже, чим більш розбавлена нітратна кислота і активніший метал, тим глибше відновлення атому Нітрогену.
3. Метали, які не розчиняються у нітратній кислоті будь-яких концентрацій, розчиняються у суміші концентрованих HNO3 та HCl (1:3) – “царська вода” (нім. Kaiser wasser). Вона розчиняє золото та платинові метали.
Сильна окисна здатність її зумовлена утворенням атомарного хлору:
3HClк. + HNO3к. = 3Сl·+ NO + 2H2O,
Au + 4HCl + HNO3 = H[AuCl4] + NO + H2O.
Суміш концентрованих HF та HNO3 – “пекельна суміш” переводить малоактивні метали в комплексні сполуки:
3Ta + 21HF + 5HNO3 = 3H2[TaF7] + NO + 10H2O.
гексафлуоротанталова (V) кислота
4. Взаємодіє з бінарними сполуками:
карбідами: 3CaC2 + 16HNO3к. = 3Ca(NO3)2 + 6CO2 + 10NO + 8H2O,
сульфідами: 3As2S3+ 28HNO3к. + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO,
гідридами: 3H2S + 2HNO3р. = 3S + 2NO + 4H2O,
фосфідами: Mg3P2 + 14HNO3к. = 3Mg(NO3)2 + 2H3PO4 + 8NO2 + 4H2O,
оксидами: As2О3 + 2HNO3к. + 2H2O = 2H3AsO4 + N2O3.
IV. Взаємодія з органічними речовинами. При дії концентрованої HNO3 більшість органічних речовин обвуглюється. Вуглеводні з нітратною кислотою утворюють нітропохідні (реакція Коновалова), спирти – естери (нітрати – нітрогліцерин, нітроцелюлоза). Характерною реакцією на білки є дія концентрованої нітратної кислоти з появою жовтого забарвлення – ксантопротеїнова реакція. Детально взаємодію нітратної кислоти з органічними речовинами розглянуто в розд. Органічна хімія.
Застосування.
Більшість нітратної кислоти використовують на виготовлення азотних добрив, вибухових речовин, барвників, для виробництва сульфатної кислоти нітрозним способом, виготовлення лаків, кіноплівки (нітроцелюлоза).
Солі нітратної кислоти – нітрати – кристалічні іонні сполуки, добре розчинні у воді.
Нітрати одержують дією нітратної кислоти на метали, оксиди, основи або солі летких кислот (карбонати).
1. Окисні властивості нітрати виявляють у розчинах лугів:
4Zn + NaNO3 + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3.
2. Сильними окисниками нітрати є у розплавах:
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O.
3. При нагріванні нітрати розкладаються, залежно від природи катіона утворюються різні продукти:
а) нітрати лужних і лужноземельних кислот розкладаються до нітриту і кисню:
2KNO3 = 2KNO2 + O2;
б) нітрати металів середньої активності утворюють оксид металу, NO2 і кисень:
Cu(NO3)2 = 2CuO + 4NO2 + O2;
в) нітратів малоактивних металів утворюють метал, NO2 і кисень:
Hg(NO3)2 = Hg + 2NO2 + O2.
Залежно від місця металу в ряду стандартних електродних потенціалів нітрати розкладаються за схемою (включаючи зазначений метал):
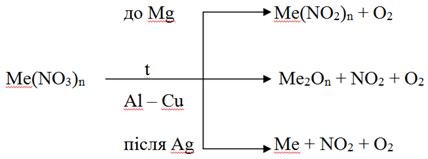
Амоніак нітрат NH4NO3 при розкладі утворює N2O і воду:
NH4NO3 = N2O + H2O
4. Оскільки при розкладі нітратів утворюється кисень, їх використовують для виготовлення чорного пороху:
2KNO3 + 3C + S = N2 + 3CO2 + K2S.
Якісною реакцією на іони NO3– є нагрівання нітратів з концентрованою сульфатною кислотою і порошком міді – утворюється бурий газ NO2:
Me(NO3)2 + Cu + H2SO4 = Cu(NO3)2 + NO2 + H2O + MeSO4.
Нітрати використовують у сільському господарстві як азотні добрива, у піротехніці для виготовлення чорного пороху і вибухових речовин.
* Азеотропна (неподільнокипляча) суміш – суміш рідин, яка кипить при певній температурі без розділення на компоненти. Так, медичний спирт (суміш 96% етанолу та 4% води) є азеотропною сумішшю.