18. ЕЛЕМЕНТИ VА ГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18. ЕЛЕМЕНТИ VА ПІДГРУПИ. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
18.6. Фосфор
Електронна будова.
Фосфор Р – другий елемент VА підгрупи Періодичної системи. Електронна конфігурація зовнішнього електронного рівня атома фосфору 3s23p3. Він – повний електронний аналог Нітрогену, однак за рахунок більшого атомного радіуса і наявності вакантного 3d-підрівня їх хімічні властивості відрізняються. Неподілена електронна пара на 3s-підрівні може розпаровуватись (атом переходить у збуджений стан) і один електрон переходить на 3d-підрівень, за рахунок чого фосфор виявляє максимальний ступінь окиснення +5 (утворює 5 ковалентних зв’язків за обмінним механізмом:
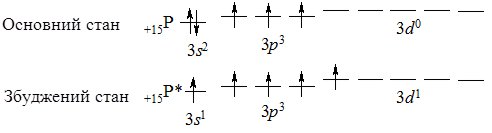
Алотропія та фізичні властивості.
Фосфор утворює кілька алотропних модифікацій з різними властивостями.
Білий фосфор – м`яка кристалічна речовина з т. пл. 44,1 0С. Розчинний у сірковуглеці CS2 та органічних розчинниках, нерозчинний у воді, тому білий фосфор зберігають під шаром води. У парах простої речовини містяться молекули P4 (рис. 18.2). Отруйний!
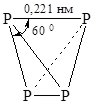
Рис. 18.2. Молекула Р4.
Ця модифікація є найбільш реакційноздатною. Нагрівання P4 без доступу повітря при 300 0С веде до утворення червоного фосфору з т. пл. 585 – 600 0С і полімерними молекулами Pn. Він менш реакційноздатний.
Чорний фосфор утворюється при нагріванні білого фосфору при 200 0С і тиску 1200 кПа. Це найстійкіша модифікація, на вигляд нагадує графіт. Чорний фосфор хімічно стійкий, не розчинний у сірковуглеці та неотруйний.
Поширення у природі.
Вміст фосфору у земній корі становить біля 0,1%. Через високу хімічну активність у вільному стані він не зустрічається, а перебуває лише у формі сполук. Найважливішими мінералами фосфору є фосфорит Ca3(PO4)2 і апатит 3Ca3(PO4)2∙CaX (X = OH, F, Cl – відповідно гідроксил-, флуоро- або хлорапатит) або Ca3(PO4)2X.
Одержання.
Фосфор вперше добув перегонкою сечі Х. Брандт (Німіччина) у 1670 р.
Сировиною для промислового одержання фосфору є апатит або фосфорит, у яких фосфор знаходиться у максимальному ступені окиснення +5. Мінерали відновлюють в електропечах у присутності вугілля і піску:
2Ca3(PO4)2 + 10C + 6SiO2 = P4↑+ 6CaSiO3 + 10CO.
Утворену пару білого фосфору P4 конденсують під водою.
Хімічні властивості.
У хімічних реакціях найактивніший білий фосфор, який записують “P4”. Інші модифікації, або коли модифікація невідома, записують “Р”.
1. Взаємодія з неметалами. Залежно від співвідношення реагентів (нестача чи надлишок фосфору) можуть утворюватись сполуки Р+3 або Р+5:
4P + 3O2 = 2P2O3, 4P + 5O2 = 2P2O5,
2P + 3Cl2 = 2PCl3, 2P + 5Cl2 = 2PCl5,
2P + 3S = P2S3, 2P + 5S = P2S5.
При гідролізі оксидів Фосфору утворюється одна з фосфатних кислот (див. Кислоти фосфору). Галогеніди і сульфіди Фосфору розкладаються водою з утворенням двох кислот:
PCl3 + 3H2O = H3PO3 + 3HCl, PCl5 + 4H2O = H3PO4 + 5HCl,
P2S3 + 6H2O = 2H3PO3 + 3H2S, P2S5 + 8H2O = 2H3PO4 + 5H2S,
тобто вони – галоген- і тіоангідриди фосфітної H2PHO3 (двоосновна кислота, її формула Н2[HPO3]) і ортофосфатної H3PO4 кислот.
З воднем фосфор безпосередньо не реагує.
2. Взаємодія з металами відбувається при нагріванні:
6Ca + P4 = 2Ca3P2.
Утворені фосфіди – солеподібні сполуки. Ступінь окиснення Фосфору у їх складі –3.
Деякі фосфіди гідролізують з утворенням газоподібного фосфіну РН3:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3.
РН3 – безбарвний газ із запахом гнилої риби, за будовою молекули схожий на амоніак, однак основні властивості РН3 виражені слабше (зокрема, не розчиняється у воді за рахунок відсутності водневих зв’язків).
Утворює солі з сильними кислотами (HCl, HI, HClO4):
PH3 + HCl = [PH4+]Cl–.
фосфонію хлорид
Солі фосфонію утворені аналогічно солям амоніаку. Гідролізують необоротно:
PH4Cl + H2O = PH4ОН+ HCl↑.
У природі фосфін утворюється при гнитті органічних решток. На повітрі він димеризується у Р2Н6, що самозаймається і горить блакитним полум`ям:
P2H6 + 4O2 = P2O5 + 3H2O.
З цим пов`язане виникнення “блукаючих вогників” на цвинтарях і болотах («вогні святого Ельма»).
3. Взаємодія з лугами при нагріванні супроводжується диспропорціюванням:
P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2.
Натрій гіпофосфіт NaH2PO2 – сіль слабкої одноосновної кислоти Н3PO2 (точніше Н[Н2PO2]).
4. Взаємодія з кислотами-окисниками веде до утворення фосфатної кислоти:
P + 5HNO3к. = H3PO4 + 5NO2 + H2O,
2P + 5H2SO4к. = 5H3PO4 + 3SO2 + H2O.
5. Суміш Армстронга використовують у виробництві сірників. При терті сірникової голівки (K2Cr2O7 + KClO3 + S + MnO2/Fe2O3) до намазки коробки (Pчерв.+скло) відбувається реакція:
6P + 5KClO3 = 5KCl + 3P2O5.
Застосування.
Фосфор використовують у виробництві сірників, димоутворюючих речовин, інсектицидів, у металургії.
У природі фосфор входить до складу нуклеїнових кислот, білків крові, мозкових, нервових тканин. У кістках хребетних тварин фосфор перебуває у вигляді кальцій ортофосфату Ca3(PO4)2.